Manganese Oxide (MnO2) Struktur Kimia, Sifat dan Penggunaannya
itu oksida mangan (MnO2) adalah senyawa kimia anorganik yang dibentuk oleh unsur mangan dengan bilangan oksidasi +4 dan oksigen, yang dalam pembentukan oksida memiliki bilangan oksidasi -2. Ia juga dikenal dengan nama mangan (IV) oksida dan anhidrida mangan.
Ini adalah kopi padat dari gelap ke hitam. Ini di alam sebagai mineral pirolusit, dendrit membentuk hitam dan mengkristal (perpanjangan bercabang). Ini dapat diperoleh sebagai residu hitam dalam reaksi antara etilen dan kalium permanganat setelah pembentukan glikol dengan aksi pengoksidasi kalium permanganat.

Ini sangat penting dalam industri kaca karena sifatnya agen pengoksidasi, karena menghilangkan warna hijau yang berasal dari senyawa ferro dan mengubahnya menjadi ferro.
Indeks
- 1 Struktur kimia
- 2 Properti
- 3 Penggunaan
- 3.1 Sebagai katalis
- 4 Efek pada kesehatan
- 5 Referensi
Struktur kimia
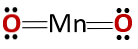
Struktur kimiawi senyawa tersebut sesuai dengan anhidrida dan bukan dengan oksida basa, seperti yang diharapkan karena terdiri dari logam dan non-logam..
Kasus khusus ini disebabkan oleh perilaku yang diasumsikan oleh mangan di berbagai tingkat oksidasi yang dimilikinya. Jadi, untuk keadaan oksidasi +2 dan +3 membentuk oksida MnO dan Mn2O3 masing-masing, bahwa ketika bereaksi dengan air mereka membentuk hidroksida mangan dan mangan hidroksida.
Namun, Mn2O3 dalam media yang sedikit asam, ia berperilaku seperti anhidrida. Dengan status oksidasi +4, +6 dan +7, MnO2, MnO3 dan MnO4 mereka membentuk asam ketika bereaksi dengan air.
Dalam media yang sedikit asam, MnO2 berperilaku seperti oksida dasar, sehingga bisa membentuk hidroksida yang sesuai.

Harus diingat bahwa dalam kasus ini tidak disebutkan sifat amfoter, yang menurutnya suatu senyawa dapat berperilaku sebagai asam atau basa. Ini adalah kasus khusus dari perilaku Mn.
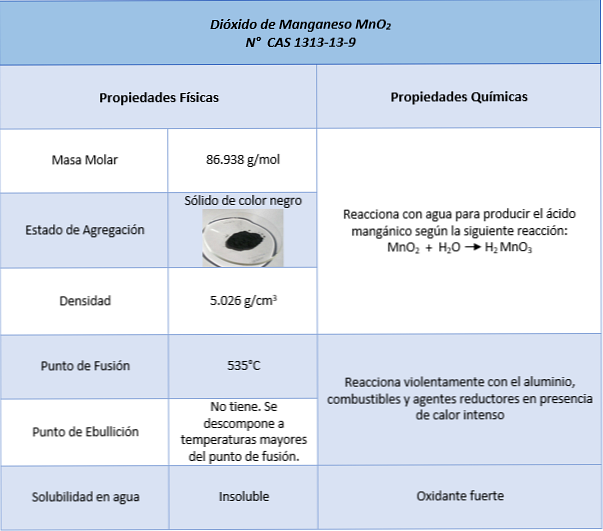
Properti
Penggunaan
- Ini digunakan sebagai sumber mangan
- Sebagai oksidan dalam baterai alkaline
- Cat untuk gelas, keramik dan porselen.
- Dalam memperoleh klorin dan yodium.
- Dalam dekomposisi hidrogen peroksida untuk pembentukan oksigen dan air gas.
- Dalam reaksi dekomposisi kalium klorat untuk produksi oksigen gas dan kalium klorida.
- Terlarut dalam aseton atau diklorometana, mengoksidasi alkohol primer menjadi aldehida dan sekunder dari keton.
- Pembuatan baterai alkaline.
Sebagai katalis
Ini berlaku untuk reaksi reduksi oksida, untuk menghilangkan sulfida seperti H2S dan kation seperti Fe+2 dan Mn+2 , arsenik dan radio ditemukan dalam air tanah yang terkontaminasi oleh senyawa jenis ini.
Kontaminasi ini dapat ditimbulkan oleh pembuangan bahan-bahan beracun yang tidak terkontrol, dengan mencuci tanah yang terkontaminasi atau dengan adanya unsur-unsur kimia pada saat melakukan ekstraksi air..
MnO2 Kemurnian tinggi yang diperoleh dari pyrolusite yang digunakan sebagai filter (Filox) adalah cara paling efektif untuk menghilangkan kotoran kelas ini dari air tanah..
Efek pada kesehatan
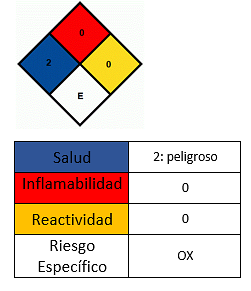
- Hindari kontak dengan kulit.
- Jika terjadi kontak, cuci area yang sesuai.
- Jangan menghirup serbuk.
- Iritasi dan kemerahan dapat dilihat pada kontak mata. Cuci dengan banyak air, biarkan air mengalir melalui mata dan minta bantuan medis jika serius.
- Dalam kontak dengan iritasi kulit dan kemerahan diamati. Cuci area yang terkena dengan banyak air dan sabun.
- Kontak kulit yang berkepanjangan menghilangkan lemak alami Anda, memicu dermatitis.
- Penghirupan dapat menyebabkan kondisi seperti flu (asap logam). Kondisi ini ditandai dengan demam tinggi, kedinginan, mulut dan tenggorokan kering, nyeri otot dan sakit kepala.
- Ini dapat mengiritasi saluran pernapasan dan meningkatkan timbulnya infeksi pernapasan (pneumonia). Intoksikasi dengan penyerapan garam mangan anorganik melalui paru-paru tidak mungkin terjadi, tetapi keracunan kronis dapat terjadi.
- Paparan kronis terhadap debu atau asap dari mangan dioksida dalam jangka waktu lama dapat memengaruhi sistem saraf pusat dan menyebabkan perkembangan penyakit Parkinson, kesulitan berjalan, kejang otot, dan perubahan perilaku.
- Tertelan dapat menyebabkan sakit perut dan mual.
- Ini tidak mudah terbakar, tetapi membantu menyebarkan api di bahan pijar. Jika dipanaskan hingga suhu di atas 535 ° C zat tersebut terurai menjadi mangan oksida (III) Mn2O3 dan oksigen, yang mudah terbakar dan meningkatkan bahaya kebakaran. Dalam hal ini api harus dipadamkan dengan busa atau karbon dioksida.
- Dalam kasus tumpahan, jangan memanipulasi kompleks tanpa perlindungan pribadi yang memadai.
- Simpan senyawa dalam wadah tertutup rapat, di tempat yang dingin dan kering dan jauh dari bahan-bahan yang tidak cocok seperti bahan organik dan bahan mudah terbakar.
- Tempat penyimpanan harus kering dan memiliki lantai yang tahan terhadap korosi asam dan dengan drainase yang baik..
- Peralatan pelindung pribadi harus digunakan, seperti sarung tangan, kacamata keselamatan, masker filter anti-uap, debu dan asap.
Referensi
- B, (2015), Manganeseoxide, The Royal Society of Chemistry - Dunia kimia, diambil dari chemistryworld.com
- Karal, (2014), Mangneso Dioxide, Safety Data Sheet, Dipulihkan dari, karal.com.mx
- Guru virtual Anda (2015-02-25). Senyawa anorganik mangan (kasus khusus 1) - Pelajaran teoretis), diambil dari, youtube.com
- Ecured, (s.f), Manganese Dioxide, Dipulihkan dari ecured.cu
- Angarita G, Johnny., (2017), Mangan Dioxide: An Exceptional Technology. Hydrotec, pulih dari hydrotecocr.com
- Fernández, G., (2015), MnO Manganese Dioxide2/ aseton, Kimia Organik, Dipulihkan dari quimicaorganica.net
- Tronox, (2011), Mangan Dioxide, Safety Data Sheet, Dipulihkan dari, tronox.com


