Formula, sifat, risiko, dan penggunaan Lithium oxide
itu lithium oksida adalah senyawa kimia anorganik dari formula Li2Atau yang terbentuk bersama dengan sejumlah kecil lithium peroksida ketika logam lithium dibakar di udara dan dikombinasikan dengan oksigen.
Sampai tahun 1990-an, pasar logam dan lithium didominasi oleh produksi AS dari deposit mineral, tetapi pada awal abad ke-21 sebagian besar produksi berasal dari sumber-sumber non-AS; Australia, Chili dan Portugal adalah pemasok paling penting di dunia. Bolivia memiliki setengah dari cadangan lithium di dunia, tetapi itu bukan produsen besar.
Bentuk komersial yang paling penting adalah lithium karbonat, Li2CO3, diproduksi dari mineral atau air asin oleh beberapa proses yang berbeda.
Ketika lithium dibakar di udara, produk utamanya adalah oksida putih dari lithium oksida, Li2O. Selain itu, beberapa litium peroksida diproduksi, Li2O2, juga putih.
Ini juga dapat dilakukan melalui dekomposisi termal lithium hidroksida, LiOH, atau lithium peroksida, Li2O2
4Li + O2(g) → 2Li2O
2LiOH + panas → Li2O (s) + H2O (g)
2Li2O2(s) + panas → 2Li2O + s2(g)
Sifat fisik dan kimia
Lithium oxide adalah padatan putih yang dikenal sebagai lithia yang tidak memiliki aroma dan rasa asin. Penampilannya ditunjukkan pada Gambar 2 (Pusat Informasi Bioteknologi Nasional, 2017).

Gambar 2: penampilan lithium oksida
Lithium oksida adalah kristal dengan geometri antiflorit yang mirip dengan natrium klorida (kubik berpusat pada wajah). Struktur kristalnya disajikan pada Gambar 3 (Mark Winter [Universitas Sheffield dan WebElements Ltd, 2016].
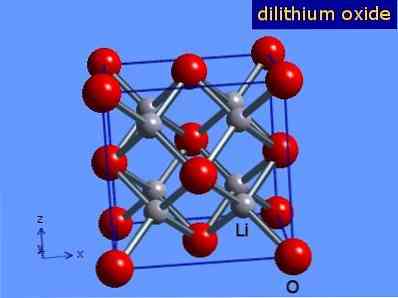
Gambar 3: struktur kristal lithium oksida.
Berat molekulnya adalah 29,88 g / mol, densitasnya adalah 2,013 g / mL dan titik lebur dan titik didih masing-masing adalah 1438 ° C dan 2066 ° C. Senyawa ini sangat larut dalam air, alkohol, eter, piridin, dan nitrobenzena (Royal Society of Chemistry, 2015).
Lithium oksida bereaksi dengan mudah dengan uap air untuk membentuk hidroksida, dan dengan karbon dioksida membentuk karbonat; oleh karena itu, harus disimpan dan ditangani dalam suasana yang bersih dan kering.
Senyawa oksida tidak menghasilkan listrik. Namun, oksida terstruktur tertentu dari perovskite adalah konduktif elektronik yang menemukan aplikasi dalam katoda sel bahan bakar oksida padat dan sistem penghasil oksigen.
Mereka adalah senyawa yang mengandung setidaknya satu anion oksigen dan satu kation logam (American Elements, S.F.).
Reaktivitas dan bahaya
Lithium oxide adalah senyawa stabil yang tidak kompatibel dengan asam kuat, air dan karbon dioksida. Sejauh pengetahuan kami, sifat kimia, fisik, dan toksikologi lithium oksida belum diselidiki dan dilaporkan secara mendalam.
Toksisitas senyawa litium adalah fungsi kelarutannya dalam air. Ion lithium memiliki toksisitas sistem saraf pusat. Senyawa ini sangat iritan korosif jika bersentuhan dengan mata, kulit, ketika dihirup atau dicerna (ESPI LOGAM, 1993).
Jika kena mata, Anda harus memeriksa apakah Anda mengenakan lensa kontak dan segera lepaskan. Mata harus dibilas dengan air mengalir selama setidaknya 15 menit, menjaga kelopak mata terbuka. Anda bisa menggunakan air dingin. Salep tidak boleh digunakan untuk mata.
Jika bahan kimia bersentuhan dengan pakaian, lepaskanlah secepat mungkin, lindungi tangan dan tubuh Anda sendiri. Tempatkan korban di bawah pancuran keselamatan.
Jika bahan kimia menumpuk di kulit korban yang terpapar, seperti tangan, cuci dengan lembut dan hati-hati kulit yang terkontaminasi dengan air yang mengalir dan sabun yang tidak kasar. Anda bisa menggunakan air dingin. Jika iritasi berlanjut, dapatkan bantuan medis. Cuci pakaian yang terkontaminasi sebelum digunakan kembali.
Dalam kasus inhalasi, korban harus dibiarkan beristirahat di area yang berventilasi baik. Jika inhalasi parah, korban harus dievakuasi ke tempat yang aman sesegera mungkin.
Longgarkan pakaian ketat seperti kerah kemeja, ikat pinggang atau dasi. Jika korban kesulitan bernapas, oksigen harus diberikan. Jika korban tidak bernafas, dilakukan resusitasi mulut ke mulut.
Selalu mempertimbangkan bahwa itu mungkin berbahaya bagi orang yang memberikan bantuan untuk memberikan resusitasi dari mulut ke mulut ketika bahan yang dihirup beracun, menular atau korosif..
Dalam semua kasus, Anda harus mencari perhatian medis segera (SIGMA-ALDRICH, 2010).
Penggunaan
Lithium oksida digunakan sebagai fluks dalam glas keramik, dan menciptakan warna biru dengan tembaga dan mawar dengan kobalt. Litium oksida bereaksi dengan air dan uap, membentuk litium hidroksida dan harus diisolasi darinya.
Lithium oxide (Li2O) dengan potensi tritiumnya yang tinggi merupakan kandidat yang menarik untuk bahan kultur padat dari pembangkit listrik fusi DT, karena tingginya densitas atom lithium (dibandingkan dengan keramik lithium atau logam lithium lainnya) dan konduktivitas termal yang relatif tinggi (LITHIUM OXIDE (Li2O), SF).
Li2Atau akan terkena suhu tinggi di bawah iradiasi neutron selama operasi selimut fusi. Dalam keadaan ini, sejumlah besar cacat iradiasi akan terjadi pada Li2Atau, seperti pembengkakan yang diinduksi helium, ekspansi termal yang relatif tinggi, pertumbuhan butir, pembentukan LiOH (T) dan presipitasi pada suhu rendah dan pengangkutan massa LiOH (T) pada suhu tinggi.
Selain itu, Li2Atau akan dikenakan tekanan yang timbul dari perbedaan ekspansi termal antara Li2O dan bahan struktural. Karakteristik Li ini2Atau mereka mengarah ke masalah teknik yang menantang dalam pembuatan dan desain selimut.
Kemungkinan penggunaan baru adalah sebagai pengganti kobal dan lithium oksida sebagai katoda dalam baterai lithium-ion yang digunakan untuk memberi daya pada perangkat elektronik dari ponsel ke laptop dan juga mobil bertenaga baterai (Reade International Corp, 2016).
Referensi
- Mark Winter [Universitas Sheffield dan WebElements Ltd. (2016). elemen web. Diambil dari Lithium: dilithium oxide webelements.com.
- Elemen Amerika. (S.F.). Lithium Oksida. Diambil dari americanelements americanelements.com.
- ESPI LOGAM. (1993, Juni). Lithium Oksida. Diambil dari espimetals espimetals.com.
- LITHIUM OXIDE (Li2O). (S.F.). Diambil dari ferp.ucsd.edu ferp.ucsd.edu.
- Pusat Nasional untuk Informasi Bioteknologi. (2017, 24 Juni). Basis Data Gabungan PubChem; CID = 166630. Diambil dari PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Lithium Oxide Powder (Li2O). Diambil dari reade reade.com
- Royal Society of Chemistry. (2015). Lithium oxide.Diambil dari chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Lembar Data Keselamatan Bahan Lithium oxide. Diambil dari chemblink chemblink.com.


