Undang-Undang Raoult tentang Apa Yang Terdiri dari Penyimpangan Positif dan Negatif
itu Hukum Raoult diusulkan oleh ahli kimia Prancis François-Marie Raoult pada tahun 1887, dan berfungsi untuk menjelaskan perilaku tekanan uap suatu larutan dari dua zat larut (biasanya ideal) tergantung pada tekanan uap parsial dari setiap komponen yang ada dalam.
Ada hukum kimia yang digunakan untuk menggambarkan perilaku zat dalam kondisi yang berbeda dan menjelaskan fenomena di mana mereka terlibat, menggunakan model matematika yang terbukti secara ilmiah. Hukum Raoult adalah salah satunya.

Menggunakan penjelasan berdasarkan interaksi antara molekul gas (atau cairan) untuk memprediksi perilaku tekanan uap, hukum ini digunakan untuk mempelajari solusi yang tidak ideal atau nyata, asalkan koefisien yang diperlukan dianggap untuk memperbaiki model. matematis dan sesuaikan dengan kondisi yang tidak ideal.
Indeks
- 1 Terdiri dari apakah itu??
- 2 Penyimpangan positif dan negatif
- 2.1 Penyimpangan positif
- 2.2 Penyimpangan negatif
- 3 Contoh
- 3.1 Campuran dasar
- 3.2 Campuran biner dengan zat terlarut yang tidak mudah menguap
- 4 Referensi
Terdiri dari apa itu??
Hukum Raoult didasarkan pada asumsi bahwa solusi yang terlibat berperilaku dengan cara yang ideal: ini terjadi karena hukum ini didasarkan pada gagasan bahwa gaya antarmolekul antara molekul yang berbeda sama dengan yang ada di antara molekul yang sama (yang itu tidak begitu berhasil dalam kenyataan).
Faktanya, semakin dekat suatu solusi dengan idealitas, semakin banyak peluang yang dimilikinya untuk memenuhi karakteristik yang diusulkan oleh undang-undang ini..
Hukum ini menghubungkan tekanan uap suatu larutan dengan zat terlarut yang tidak mudah menguap, yang menyatakan bahwa itu akan sama dengan tekanan uap zat terlarut murni itu pada suhu itu, dikalikan dengan fraksi molarnya. Ini dinyatakan dalam istilah matematika untuk satu komponen dengan cara berikut:
Psaya = Pºsaya . Xsaya
Dalam ungkapan ini Psaya sama dengan tekanan uap parsial komponen i dalam campuran gas, Pºsaya adalah tekanan uap dari komponen i murni, dan Xsaya adalah fraksi mol komponen i dalam campuran.
Dengan cara yang sama, ketika Anda memiliki beberapa komponen dalam suatu larutan dan mereka telah mencapai kondisi setimbang, Anda dapat menghitung tekanan uap total larutan dengan menggabungkan hukum Raoult dengan Dalton's:
P = PºAXA + PºBXB + PºCXc...
Juga, dalam solusi tersebut di mana hanya ada satu zat terlarut dan pelarut yang ada, hukum dapat dirumuskan seperti yang ditunjukkan di bawah ini:
PA = (1-XB) x PºA
Penyimpangan positif dan negatif
Solusi yang dapat dipelajari dengan hukum ini biasanya harus berperilaku ideal, karena interaksi antara molekul-molekulnya kecil dan memungkinkan sifat yang sama untuk diasumsikan di seluruh solusi tanpa kecuali..
Namun, solusi ideal sebenarnya tidak ada dalam kenyataan, sehingga dua koefisien harus dimasukkan ke dalam perhitungan yang mewakili interaksi antar molekul. Ini adalah koefisien fugacity dan koefisien aktivitas.
Dalam hal ini, penyimpangan sehubungan dengan hukum Raoult didefinisikan sebagai positif atau negatif, tergantung pada hasil yang diperoleh pada saat itu.
Penyimpangan positif
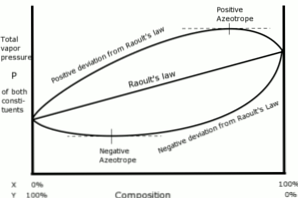
Penyimpangan positif sehubungan dengan hukum Raoult terjadi ketika tekanan uap larutan lebih besar dari apa yang dihitung dengan hukum Raoult.
Ini terjadi ketika gaya kohesi antara molekul yang sama lebih besar dari kekuatan yang sama antara molekul yang berbeda. Dalam hal ini, kedua komponen lebih mudah menguap.
Penyimpangan ini terlihat dalam kurva tekanan uap sebagai titik maksimum dalam komposisi tertentu, membentuk azeotrop positif.
Azeotrop adalah campuran cairan dari dua atau lebih senyawa kimia yang berperilaku seolah-olah itu dibentuk oleh komponen tunggal dan menguap tanpa mengubah komposisi..
Penyimpangan negatif
Penyimpangan negatif dari hukum Raoult terjadi ketika tekanan uap campuran lebih rendah dari yang diharapkan setelah perhitungan dengan hukum.
Penyimpangan ini muncul ketika gaya kohesi antara molekul-molekul campuran lebih besar dari rata-rata gaya antara partikel-partikel cairan dalam keadaan murni mereka..
Jenis deviasi ini menghasilkan retensi setiap komponen dalam keadaan cairnya oleh gaya tarik yang lebih besar daripada zat dalam keadaan murni, sehingga tekanan uap parsial sistem berkurang.
Azeotrop negatif dalam kurva tekanan uap mewakili titik minimum, dan menunjukkan afinitas antara dua atau lebih komponen yang terlibat dalam campuran.
Contohnya
Hukum Raoult biasanya digunakan untuk menghitung tekanan suatu solusi berdasarkan gaya antarmolekulnya, membandingkan nilai yang dihitung dengan nilai riil untuk menyimpulkan jika ada penyimpangan dan jika ini harus positif atau negatif. Berikut adalah dua contoh penggunaan hukum Raoult:
Campuran dasar
Campuran berikut, terdiri dari propana dan butana, mewakili perkiraan tekanan uap, dan kita dapat mengasumsikan bahwa kedua komponen memiliki proporsi yang sama di dalamnya (50-50), pada suhu 40 ° C:
Xpropana = 0,5
Pºpropana = 1352.1 kPa
Xbutana = 0,5
Pºbutana = 377.6 kPa
Itu dihitung dengan hukum Raoult:
Pberbaur = (0,5 x 377,6 kPa) + (0,5 x 1352,1 kPa)
Jadi:
Pberbaur = 864.8 kPa
Campuran biner dengan zat terlarut yang tidak mudah menguap
Kadang-kadang terjadi bahwa zat terlarut campuran tidak mudah menguap, sehingga hukum digunakan untuk memahami perilaku tekanan uap.
Diberikan campuran air dan gula dalam proporsi masing-masing 95% dan 5%, dan dalam kondisi suhu normal:
Xair = 0,95
Pºair = 2.34 kPa
Xgula = 0,05
Pºgula = 0 kPa
Itu dihitung dengan hukum Raoult:
Pberbaur = (0,95 x 2,34 kPa) + (0,05 x 0 kPa)
Jadi:
Pberbaur = 2.22 kPa
Jelas telah terjadi depresi tekanan uap air karena efek dari kekuatan antarmolekul.
Referensi
- Anne Marie Helmenstine, P. (s.f.) Definisi Hukum Raoult. Diperoleh dari thinkco.com
- ChemGuide. (s.f.). Hukum Raoult dan Larutan Non-Volatile. Diperoleh dari chemguide.co.uk
- LibreTexts. (s.f.). Hukum Raoult dan Campuran Cairan Ideal. Diperoleh dari chem.libretexts.org
- Netral. (s.f.). Hukum Raoult. Diperoleh dari neutrium.net
- Wikipedia. (s.f.). Hukum Raoult. Diperoleh dari en.wikipedia.org


