Yayasan Nain, Reagen dan Teknik Ziehl-Neelsen
itu Noda Ziehl-Neelsen dalam teknik pewarnaan untuk mengidentifikasi mikroorganisme tahan asam-alkohol (AAR). Nama prosedur mikrobiologi ini mengacu pada penulisnya: ahli bakteriologi Franz Ziehl dan ahli patologi Friedrich Neelsen.
Teknik ini adalah jenis pewarnaan diferensial, yang menyiratkan penggunaan pewarna yang berbeda untuk menciptakan kontras antara struktur yang ingin Anda amati, bedakan, dan kemudian identifikasi. Ziehl-Neelsen stain digunakan untuk mengidentifikasi beberapa jenis mikroorganisme.
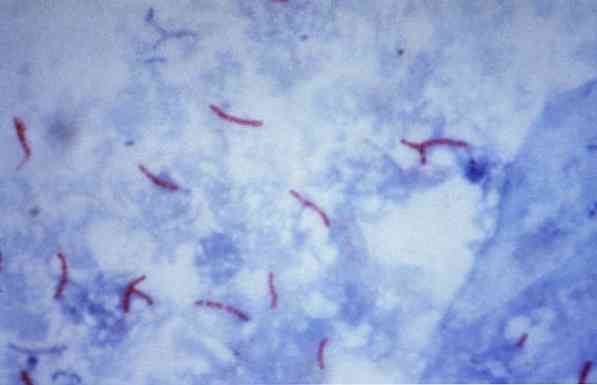
Beberapa mikroorganisme ini adalah mikobakteri (misalnya, Mycobacterium tuberculosis), nocardias (misalnya, Nocardia sp.) dan beberapa parasit uniseluler (misalnya, Cryptosporidium parvum). Banyak bakteri dapat diklasifikasikan melalui teknik umum yang disebut pewarnaan Gram.
Namun, beberapa kelompok bakteri memerlukan metode lain untuk mengidentifikasi mereka. Teknik seperti pewarnaan Ziehl-Neelsen membutuhkan kombinasi pewarna dengan panas untuk memperbaiki yang pertama ke dinding sel.
Kemudian muncul proses perubahan warna yang memungkinkan dua hasil: resistensi atau sensitivitas terhadap perubahan warna oleh asam dan alkohol.
Indeks
- 1 Yayasan
- 1.1 Pewarnaan sekunder
- 2 Pereaksi
- 2.1 Pewarnaan primer
- 2.2 Solusi penghilangan warna
- 2.3 Pewarnaan sekunder (anti-pewarna)
- 3 Teknik
- 3.1 Prosedur pewarnaan tahan asam
- 4 Referensi
Yayasan
Dasar dari teknik pewarnaan ini didasarkan pada sifat dinding sel dari mikroorganisme ini. Dindingnya dibentuk oleh sejenis asam lemak yang disebut asam mikolik; Ini ditandai dengan rantai yang sangat panjang.
Ketika asam lemak memiliki struktur yang sangat panjang, mereka dapat mempertahankan pewarna dengan lebih mudah. Beberapa genera bakteri sangat sulit diwarnai oleh pewarnaan Gram, karena kandungan asam mikolik yang tinggi pada dinding sel.
Dalam pewarnaan Ziehl-Neelsen, senyawa fenolik carbol fuchsin, pewarna dasar, digunakan. Ini memiliki kemampuan untuk berinteraksi dengan asam lemak dinding sel, yang merupakan tekstur lilin pada suhu kamar.
Pewarnaan carbol fuchsin ditingkatkan di hadapan panas, karena lilin meleleh dan molekul pewarna bergerak lebih cepat ke dinding sel.
Asam yang digunakan kemudian berfungsi untuk menghitamkan sel-sel yang tidak ternoda karena dindingnya tidak cukup terkait dengan pewarna; oleh karena itu, kekuatan penghilang asam asam mampu menghilangkan pewarna asam. Sel-sel yang melawan perubahan warna ini disebut tahan asam.
Pewarnaan sekunder
Setelah perubahan warna sampel, ini kontras dengan pewarna lain yang disebut pewarna sekunder. Metilen biru atau hijau perunggu umumnya digunakan.
Pewarna sekunder mewarnai bahan latar belakang dan, akibatnya, menciptakan kontras dengan struktur yang diwarnai pada langkah pertama. Hanya sel-sel yang berubah warna yang menyerap pewarna kedua (anti-noda) dan mengambil warnanya, sedangkan sel-sel yang tahan asam mempertahankan warna merah..
Prosedur ini sering digunakan untuk identifikasi Mycobacterium tuberculosis dan Mycobacterium leprae, yang disebut basil tahan asam.
Reagen
Pewarnaan primer
Carboxin 0,3% fuchsin (difilter) digunakan. Zat ini dibuat dari campuran alkohol: fenol dalam etanol (90%) atau metanol (95%), dan dalam campuran ini 3 gram fuchsin dasar dilarutkan..
Solusi dekolorisasi
Pada langkah ini Anda bisa menggunakan larutan asam alkohol 3% atau asam sulfat 25%.
Pewarnaan sekunder (anti-pewarna)
Zat warna yang paling umum digunakan untuk melakukan kontras dalam sampel biasanya 0,3% metilen biru. Namun, yang lain juga dapat digunakan, seperti hijau malachite 0,5%.
Teknik
Prosedur pewarnaan tahan asam
Siapkan apusan bakteri
Persiapan ini dibuat pada slide yang bersih dan kering, mengikuti tindakan pencegahan sterilitas.
Mengeringkan apusan
Biarkan apusan mengering pada suhu kamar.
Panaskan sampel
Sampel harus dipanaskan dengan menerapkan api ke slide di bawah ini. Fiksasi dengan alkohol dapat dilakukan ketika apusan belum disiapkan dengan dahak (diobati dengan natrium hipoklorit untuk memutihkannya) dan jika tidak akan segera dicelup..
M. tuberculosis Ini dihilangkan dengan pemutih dan selama proses pewarnaan. Thermofixing dari dahak yang tidak diobati tidak akan membunuh M. tuberculosis, sedangkan fiksasi dengan alkohol bersifat bakterisidal.
Tutupi noda
Noda ditutup dengan larutan carbol fuchsin (pewarna dasar primer).
Panaskan noda
Ini dilakukan selama 5 menit. Anda harus melihat pelepasan uap (sekitar 60 ° C). Penting untuk tidak terlalu panas dan menghindari membakar sampel.
Berkenaan dengan pemanasan noda, harus sangat hati-hati ketika memanaskan fuchsin carbol, terutama jika pewarnaan dilakukan pada baki atau wadah lain di mana bahan kimia yang sangat mudah terbakar dikumpulkan dari noda sebelumnya..
Hanya nyala api kecil yang harus diaplikasikan di bawah slide menggunakan swab yang menyala yang sebelumnya dibasahi dengan beberapa tetes alkohol asam, metanol atau 70% etanol. Hindari menggunakan swab besar yang direndam dalam etanol karena ini merupakan bahaya kebakaran.
Cuci noda
Pencucian ini harus dilakukan dengan air bersih. Jika air keran tidak bersih, cuci apusan dengan air saring atau air suling, lebih disukai.
Tutupi apusan dengan alkohol asam
Alkohol asam ini harus 3%. Cakupan dilakukan selama 5 menit atau sampai apusan cukup berubah warna, yaitu merah muda pucat.
Harus dipertimbangkan bahwa alkohol asam mudah terbakar; oleh karena itu, itu harus digunakan dengan sangat hati-hati. Hindari berada di dekat sumber penyulut.
Cuci noda
Pencucian harus dengan air bersih dan suling.
Tutupi apusan dengan pewarna
Dapat berupa pewarna hijau malachite (0,5%) atau biru metilen (0,3%) selama 1 atau 2 menit, menggunakan waktu terlama jika apusan tipis..
Cuci noda
Air bersih harus digunakan lagi (suling).
Tiriskan
Bagian belakang slide harus dibersihkan dan noda harus diletakkan di rak drainase, sehingga udara kering (jangan gunakan kertas penyerap untuk pengeringan).
Periksa apusan di mikroskop
Sasaran 100X dan minyak imersi harus digunakan. Pindai apusan secara sistematis dan tuliskan pengamatan yang relevan.
Tafsirkan hasilnya
Secara teoritis, mikroorganisme yang diwarnai dengan warna kemerahan dianggap positif asam-cepat (AAR +).
Sebaliknya, jika mikroorganisme bernoda biru atau hijau, tergantung pada pewarna yang digunakan sebagai pewarna-balik, mereka dianggap asam resisten alkohol negatif (AAR-).
Referensi
- Apurba, S. & Sandhya, B. (2016). Esensi Mikrobiologi Praktis (Edisi pertama). Penerbit Medis Jaypee Brothers.
- Bauman, R. (2014). Mikrobiologi dengan Penyakit oleh Sistem Tubuh (4th ed.). Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, A. (1996). Mikrobiologi Pengantar (Edisi pertama). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Manual Laboratorium dan Buku Kerja dalam Mikrobiologi: Aplikasi untuk Perawatan Pasien (Edisi ke-11). Pendidikan McGraw-Hill.
- Vasanthakumari, R. (2007). Buku Teks Mikrobiologi (Edisi pertama). B.I. Publikasi PVT.


