Giemsa pewarnaan fondasi, bahan, teknik dan kegunaan
itu Noda Giemsa adalah jenis pewarnaan sampel klinis, berdasarkan campuran asam dan pewarna dasar. Penciptaannya terinspirasi oleh karya yang dilakukan oleh Romanowsky, di mana Gustav Giemsa, ahli kimia dan bakteriolog berasal dari Jerman, menyempurnakannya dengan menambahkan gliserol untuk menstabilkan senyawa..
Perubahan yang dihasilkan oleh teknik asli Romanowsky memungkinkan untuk meningkatkan pengamatan mikroskopis, oleh karena itu teknik ini dibaptis dengan nama pewarnaan Giemsa.
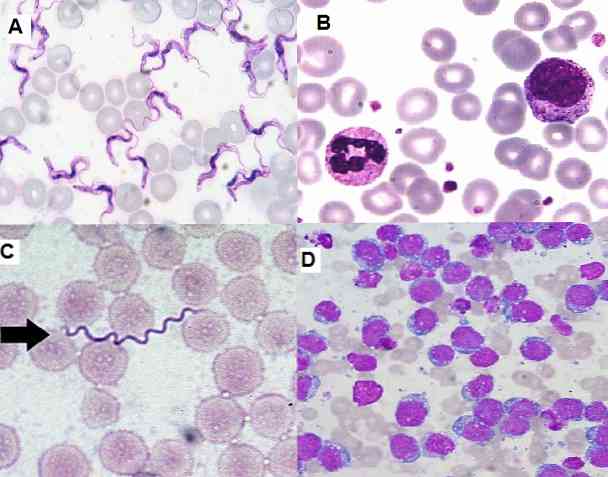
Karena ini adalah teknik yang sederhana untuk dilakukan, sangat fungsional dan ekonomis, saat ini banyak digunakan di laboratorium klinis untuk apusan hematologi, sampel sumsum tulang dan bagian jaringan..
Teknik pewarnaan Giemsa sangat berguna untuk studi sitologi, karena memungkinkan pengamatan struktur sel tertentu. Teknik ini menodai sitoplasma, nuklei, nukleolus, vakuola, dan butiran sel, yang mampu membedakan jejak halus kromatin.
Selain itu, perubahan signifikan dalam ukuran, bentuk atau warna nukleus dapat dideteksi, di mana dimungkinkan untuk memvisualisasikan hilangnya hubungan nukleus-sitoplasma..
Di sisi lain, memungkinkan untuk mengidentifikasi sel-sel yang belum matang dalam sumsum tulang dan darah tepi, yang penting untuk diagnosis penyakit serius seperti leukemia. Dimungkinkan juga untuk mendeteksi hemoparasit, bakteri ekstra dan intraseluler, jamur, dan lainnya.
Dalam sitogenetika cukup digunakan, karena dimungkinkan untuk mempelajari mitosis sel.
Indeks
- 1 Yayasan pewarnaan Giemsa
- 2 Bahan
- 2.1 Bahan untuk persiapan solusi ibu
- 2.2 Mode persiapan solusi ibu
- 2.3 Bahan untuk menyiapkan solusi buffer
- 2.4 Persiapan akhir pewarna
- 2.5 Bahan tambahan yang dibutuhkan untuk melakukan pewarnaan
- 3 Teknik
- 3.1 Proses pewarnaan
- 4 Utilitas
- 4.1 Hematologi
- 4.2 Mikologi
- 4.3 Bakteriologi
- 4.4 Parasitologi
- 4.5 Sitologi
- 4.6 Sitogenetika
- 5 Penelitian yang menunjukkan efektivitas pewarnaan Giemsa
- 6 Rekomendasi untuk pewarnaan yang baik
- 7 Kesalahan umum dalam pewarnaan Giemsa
- 7.1 Pewarnaan yang sangat biru
- 7.2 Pewarnaan pink yang berlebihan
- 7.3 Kehadiran endapan dalam apusan
- 7.4 Kehadiran artefak morfologis
- 8 mode penyimpanan
- 9 Referensi
Yayasan pewarnaan Giemsa
Jenis pewarna Romanowsky didasarkan pada penggunaan kontras antara pewarna asam dan basa, untuk mencapai pewarnaan struktur basa dan asam, masing-masing. Seperti yang dapat dilihat ada afinitas dari pewarna asam untuk mewarnai struktur dasar dan sebaliknya.
Pewarna dasar yang digunakan adalah metilen biru dan turunannya yang teroksidasi (Azure A dan Azure B), sedangkan pewarna asam adalah eosin.
Struktur asam sel adalah asam nukleat, butiran basofil tersegmentasi, antara lain, oleh karena itu mereka akan dicelup dengan metilen biru.
Dalam pengertian yang sama, struktur dasar sel adalah hemoglobin dan beberapa butiran seperti yang terkandung dalam eosinofil tersegmentasi, antara lain; ini akan dicelup dengan eosin.
Di sisi lain, karena fakta bahwa metilen biru dan biru ditandai oleh pewarna metakromatik, mereka dapat memberikan nada variabel ke struktur yang berbeda sesuai dengan beban polianion yang mereka miliki..
Ini adalah bagaimana kombinasi strategis dari pewarna dasar dan asam mampu mengembangkan spektrum warna yang luas, sesuai dengan karakteristik biokimia dari setiap struktur, berjalan melalui nada biru pucat, biru tua, ungu dan ungu dalam kasus struktur asam.
Sementara warna yang disediakan oleh eosin lebih stabil, menghasilkan warna antara oranye kemerahan dan salmon.
Materi
Bahan untuk persiapan solusi ibu
Penyusunan larutan stok membutuhkan berat 600 mg pewarna Giemsa bubuk, mengukur 500 cc alkohol metil bebas aseton dan 50 cc gliserin netral.
Mode persiapan solusi ibu
Tempatkan bubuk Giemsa yang berat di dalam mortar. Jika ada benjolan, mereka harus disemprot. Selanjutnya tambahkan jumlah gliserin yang terukur dan aduk rata. Campuran yang diperoleh dituangkan ke dalam botol amber yang sangat bersih.
Sisa gliserin ditempatkan dalam mortar. Campur lagi untuk membersihkan sisa pewarna yang menempel di dinding mortar dan tuangkan ke dalam botol yang sama.
Botol ditutup dan dibawa selama 2 jam dalam bak air pada suhu 55ºC. Saat mandi bain-marie, aduk perlahan campuran setiap setengah jam.
Selanjutnya, campuran dibiarkan dingin untuk menempatkan alkohol. Sebelumnya, bagian dari alkohol yang diukur ditempatkan dalam mortar untuk menyelesaikan pencucian sisa pewarna dan kemudian ditambahkan ke campuran bersama dengan sisa alkohol..
Persiapan ini harus dibiarkan matang setidaknya selama 2 minggu. Bagian yang digunakan dari larutan ibu harus disaring.
Untuk menghindari kontaminasi persiapan, disarankan untuk melewatkan bagian yang akan digunakan terus-menerus ke botol kuning kecil dengan pipet. Isi ulang setiap kali reagen habis.
Bahan untuk mempersiapkan solusi Buffer
Di sisi lain, larutan buffer pada pH 7,2 disiapkan sebagai berikut:
6,77 gram natrium fosfat (anhidrat) ditimbang (NaHPO4), 2,59 g kalium dihidrogen fosfat (KH)2PO4) dan air suling hingga 1000 cc.
Persiapan akhir pewarna
Untuk persiapan larutan pewarnaan akhir, 2 cc larutan stok yang disaring diukur dan dicampur dengan 6 cc larutan buffer. Campuran diaduk.
Fakta yang relevan yang harus diperhitungkan, adalah bahwa teknik persiapan pewarna dapat berubah sesuai dengan rumah komersial.
Bahan tambahan dibutuhkan untuk melakukan pewarnaan
Terlepas dari bahan-bahan yang dijelaskan, itu harus dilengkapi dengan jembatan warna, layar air atau penyangga untuk mencuci, lembaran untuk benda atau penutup, stopwatch untuk mengontrol waktu pewarnaan dan kertas blotting atau beberapa bahan yang dapat digunakan untuk mengeringkan ( kasa atau kapas).
Teknik
Proses pewarnaan
1) Sebelum mewarnai, Anda harus memiliki sampel tersebar di slide yang bersih..
Sampel dapat berupa darah, sumsum tulang, potongan jaringan histologis atau sampel serviks-vagina. Direkomendasikan agar bagian luarnya tipis dan memiliki 1 atau 2 jam pengeringan sebelum diwarnai.
2) Semua lembar yang harus Anda warnai ditempatkan pada jembatan berwarna. Selalu bekerja dalam urutan yang sama dan identifikasi setiap lembar dengan baik.
3) Tempatkan beberapa tetes 100% metil alkohol (metanol) pada apusan dan biarkan selama 3 hingga 5 menit, untuk memperbaiki dan mendehidrasi sampel.
4) Buang metanol yang ada di lembaran dan biarkan udara kering.
5) Setelah kering, tempatkan larutan pewarna akhir dengan pipet sampai seluruh lembaran tertutup. Biarkan selama 15 menit. Beberapa penulis merekomendasikan hingga 25 menit. Tergantung rumah komersial.
6) Kuras pewarna dan cuci apusan dengan air suling atau dengan larutan buffer 7,2.
7) Pada kertas blotting biarkan lembaran mengering di udara terbuka, diatur secara vertikal dengan bantuan penopang.
8) Seka bagian belakang slide dengan kain kasa atau kapas yang dilembabkan dengan alkohol untuk menghilangkan pewarna yang tersisa.
Utilitas
Teknik pewarnaan Giemsa digunakan di beberapa daerah, termasuk: hematologi, mikologi, bakteriologi, parasitologi, sitologi dan sitogenetika.
Hematologi
Ini adalah utilitas yang paling sering diberikan untuk pewarnaan ini. Dengan itu, kita dapat mengidentifikasi masing-masing dan setiap sel yang hadir dalam sampel sumsum tulang atau darah tepi. Selain memperkirakan jumlah masing-masing seri, dapat mendeteksi leukositosis atau leukopenia, trombositopenia, dll..
Karena sensitif untuk mengidentifikasi sel-sel yang belum matang, itu relevan dalam diagnosis leukemia akut atau kronis. Dimungkinkan juga untuk mendiagnosis anemia, seperti penyakit sel sabit, penyakit sel sabit, dan lainnya..
Mikologi
Di area ini biasa digunakan untuk mencari Histoplasma capsulatum (Jamur dimorfik intraseluler) dalam sampel jaringan.
Bakteriologi
Pada apusan hematologis yang diwarnai dengan Giemsa dimungkinkan untuk dideteksi Borrelias sp pada pasien yang memiliki penyakit yang disebut demam berulang. Spirochetes berlimpah di antara eritrosit, dalam sampel yang diambil di puncak demam.
Juga dimungkinkan untuk memvisualisasikan bakteri intraseluler sebagai Rickettsias sp dan Chlamydia trachomatis dalam sel yang terinfeksi.
Parasitologi
Di bidang parasitologi, pewarnaan Giemsa telah memungkinkan diagnosis penyakit parasit seperti malaria, penyakit Chagas dan leishmaniasis..
Pada dua parasit pertama Plasmodium sp dan Trypanosoma cruzi masing-masing mereka dapat divisualisasikan dalam darah tepi pasien yang terinfeksi, mereka dapat ditemukan dalam berbagai tahap sesuai dengan fase di mana penyakit ini.
Untuk meningkatkan pencarian parasit darah, disarankan untuk menggunakan pewarna Giemsa yang dicampur dengan pewarna May-Grünwald.
Demikian juga, leishmaniasis kulit dapat didiagnosis ketika mengevaluasi sampel biopsi kulit yang diwarnai dengan Giemsa, di mana parasit ditemukan.
Sitologi
Pewarnaan Giemsa juga digunakan untuk studi sitologi sampel endoserviks, meskipun itu bukan teknik yang paling sering digunakan untuk tujuan ini..
Tetapi dalam kasus kelangkaan sumber daya dapat digunakan, memiliki fungsi yang mirip dengan yang ditawarkan oleh teknik Papanicolaou dan dengan biaya lebih rendah. Namun, itu membutuhkan keahlian dari pihak penguji.
Sitogenetika
Ciri Giemsa yang relevan adalah kemampuannya mengikat kuat pada daerah yang kaya akan adenin DNA dan timin. Ini memungkinkan DNA untuk divisualisasikan selama mitosis sel, di berbagai kondisi kondensasi.
Studi-studi ini diperlukan untuk mendeteksi penyimpangan kromatik seperti duplikasi, penghapusan atau translokasi dari berbagai daerah kromosom..
Penelitian menunjukkan kemanjuran pewarnaan Giemsa
Cannova et al (2016), membandingkan 3 teknik pewarnaan untuk diagnosis leishmaniasis kulit.
Untuk ini, mereka menggunakan sampel yang diperoleh dari hewan percobaan (Mesocrisetus auratus) diinokulasi secara eksperimental dengan Leishmanias.
Para penulis menunjukkan bahwa pewarnaan Giemsa lebih baik daripada pewarnaan Pap-mart® dan Gaffney. Oleh karena itu, mereka menganggap bahwa pewarnaan Giemsa ideal untuk mendiagnosis leishmaniasis kulit.
Hasil yang sangat baik yang diperoleh oleh penulis adalah karena fakta bahwa kombinasi pewarna yang membentuk campuran Giemsa menyajikan kondisi yang diperlukan untuk menciptakan kontras yang menguntungkan, memungkinkan dengan jelas membedakan struktur amastigote, baik intra maupun ekstraseluler..
Teknik-teknik lain (Pap-mart® dan Gaffney) juga melakukannya, tetapi dengan cara yang lebih lemah dan karenanya lebih sulit untuk divisualisasikan. Itulah sebabnya pewarnaan Giemsa direkomendasikan untuk diagnosis parasitologis leishmaniasis.
Demikian juga, sebuah studi oleh Ramirez dkk (1994), mengevaluasi validitas noda Giemsa dan Lendrum dalam apusan konjungtiva untuk identifikasi Chlamydia trachomatis.
Para penulis menentukan bahwa pewarnaan Giemsa dan Ledrum memiliki kekhususan yang sama, tetapi Giemsa lebih sensitif.
Ini menjelaskan mengapa saat ini pewarnaan Giemsa adalah yang paling sering digunakan untuk diagnosis infeksi klamidia, terutama jika ada sedikit sumber daya.
Rekomendasi untuk pewarnaan yang baik
Pengeringan lembaran tidak harus dipercepat. Waktu yang bijaksana harus ditunggu untuk mengeringkannya di udara terbuka. Sekitar 2 jam.
Warnai segera setelah 2 jam untuk hasil terbaik.
Agar apusan diperbaiki dan diwarnai lebih baik, sampel harus didistribusikan pada lembaran sedemikian rupa sehingga lapisan tipis dan seragam tetap ada..
Sampel darah yang disukai adalah kapiler, karena apusan dibuat langsung dari setetes darah dan oleh karena itu sampel tidak memiliki aditif, yang mendukung pemeliharaan struktur sel.
Namun, jika darah vena digunakan EDTA harus digunakan sebagai antikoagulan dan bukan heparin, karena yang terakhir biasanya merusak sel..
Kesalahan umum dalam pewarnaan Giemsa
Dalam praktik pewarnaan ini, kesalahan bisa dibuat. Mereka dibuktikan dengan perubahan tiba-tiba dalam nuansa struktur.
Pewarnaan yang sangat biru
Ini bisa disebabkan oleh:
- Corengan sangat tebal
- Melebihi waktu pewarnaan
- Terlalu sedikit mencuci.
- Penggunaan reagen jauh di atas pH netral (alkali).
Dalam kondisi ini warna-warna dari struktur berikut terdistorsi, sehingga eritrosit bukannya merah muda-salmon akan terlihat hijau, butiran eosinofil yang harus diwarnai bata merah akan berubah menjadi biru atau abu-abu dan seterusnya akan ada penyimpangan dalam nada biasa.
Warna pink yang berlebihan
Mungkin karena:
- Waktu pewarnaan tidak cukup.
- Pencucian berkepanjangan atau berlebihan.
- Pengeringan buruk.
- Gunakan reagen yang sangat asam.
Dalam kasus khusus ini, struktur yang biasanya bernoda biru tidak akan hampir terlihat, sedangkan struktur yang bernoda merah muda akan memiliki nada suara yang sangat berlebihan.
Contoh: eritrosit akan berwarna merah terang atau oranye yang kuat, kromatin nuklir akan terlihat merah muda pucat dan butiran eosinofil akan menjadi merah cerah..
Kehadiran endapan di apusan
Penyebabnya bisa:
- Gunakan seprai kotor atau tidak dicuci dengan baik.
- Jangan biarkan apusan mengering dengan baik.
- Biarkan solusi perbaikan terlalu lama.
- Cuci yang tidak memadai pada akhir pewarnaan.
- Filtrasi yang tidak memadai atau non-filtrasi pewarna yang digunakan.
Kehadiran artefak morfologis
Artefak morfologis dapat muncul pada apusan, sehingga sulit untuk memvisualisasikan dan menafsirkan struktur yang ada. Ini disebabkan oleh:
- Jenis antikoagulan yang digunakan, seperti heparin.
- Gunakan lembaran yang kotor, rusak atau berminyak.
Mode penyimpanan
Setelah persiapan, pewarna harus disimpan pada suhu kamar (15 - 25 ° C), untuk mencegah pewarna mengendap. Itu harus disimpan dalam wadah amber tertutup.
Referensi
- Cannova D, Brito E dan Simons M. Evaluasi teknik pewarnaan untuk diagnosis Leishmaniasis kulit. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW Reagen. Noda Giemsa. Versi 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Spanyol.
- Clark G. Pewarnaan prosedur (1981), 4thed. Williams & Willkins.
- Kimia Klinik Terapan Giemsa dye untuk diagnosis in vitro. Distributor: cromakit.es
- Ramírez I, Mejía M, García de la Riva J, Hermes F dan Grazioso C. Validitas noda Giemsa dan Lendrum dalam apusan konjungtiva untuk identifikasi Chlamydia trachomatis. Bol dari Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. General Mycology. 1994. Edisi ke-2 Universidad Central de Venezuela, edisi Perpustakaan. Venezuela, Caracas.
- "Noda Giemsa." Wikipedia, Ensiklopedia gratis. 1 Sep 2017, 01:02 UTC. 6 Des 2018, en.wikipedia.org.


