Spora pewarnaan dasar, teknik dan kegunaan
itu pewarnaan spora adalah metodologi yang digunakan untuk mewarnai struktur resistensi yang membentuk beberapa genera bakteri ketika mereka berada dalam kondisi yang tidak menguntungkan; struktur ini sesuai dengan cara bertahan hidup.
Ada banyak genus yang membentuk spora; Namun, yang utama adalah Bacillus dan Clostridium. Genera ini dianggap lebih relevan karena mereka memiliki spesies patogen untuk manusia.
Setiap basil dapat memunculkan spora. Pada saat persiapan pewarnaan, spora dapat ditemukan di dalam bacillus (endospore) atau di luarnya (exospore). Dengan teknik pewarnaan konvensional untuk bakteri - seperti pewarnaan Gram - spora tetap tidak berwarna.
Saat ini, ada beberapa metodologi pewarnaan yang mampu melintasi struktur tebal spora untuk mewarnainya. Metodologi ini sangat bervariasi; di antaranya kita dapat menyebutkan teknik Dorner, pewarnaan Möeller dan metodologi Shaeffer-Fulton, juga dikenal sebagai Wirtz-Conklin..
Dari semua teknik yang disebutkan, metodologi Shaeffer-Fulton adalah yang paling banyak digunakan di laboratorium rutin. Itu berutang namanya kepada dua ahli mikrobiologi yang menciptakan warna pada tahun 1930: Alicia Shaeffer dan MacDonald Fulton. Namun, kadang-kadang teknik ini disebut Wirtz-Conklin untuk menghormati dua ahli bakteriologi tahun 1900-an.
Indeks
- 1 Yayasan
- 2 Teknik pewarnaan spora
- 2.1 Teknik Dorner
- 2.2 Teknik Dorner yang Dimodifikasi
- 2.3 Teknik Shaeffer-Fulton atau Wirtz-Conklin
- 2.4 Teknik Möeller
- 2.5 Teknik Möeller yang dimodifikasi tanpa panas
- 3 Penggunaan
- 3.1 Contoh
- 4 Referensi
Yayasan
Spora tidak diwarnai dengan pewarnaan konvensional karena memiliki dinding yang sangat tebal. Komposisi spora yang kompleks mencegah masuknya sebagian besar pewarna.
Jika spora dipelajari dari luar ke dalam, lapisan berikut diamati: pertama, exosporium, yang merupakan lapisan luar paling tipis yang dibentuk oleh glikoprotein..
Kemudian datang kutikula, yang memberikan resistensi terhadap suhu tinggi, diikuti oleh korteks yang terdiri dari peptidoglikan. Lalu ada dinding alas yang melindungi protoplas.
Spora adalah struktur dehidrasi yang mengandung 15% kalsium dan asam dipicolinic. Oleh karena itu, sebagian besar teknik pewarnaan spora didasarkan pada aplikasi panas sehingga pewarna dapat menembus struktur tebal.
Sekali spora dicelup, tidak bisa menghilangkan pewarna. Dalam teknik Shaeffer-Fulton, malachite green memasuki sel-sel vegetatif dan, setelah aplikasi panas, menembus endospore dan juga eksospora.
Saat mencuci dengan air, zat pewarna dikeluarkan dari sel vegetatif. Ini terjadi karena pewarna malachite hijau sedikit dasar, sehingga mengikat lemah ke sel vegetatif.
Di sisi lain, itu tidak bisa keluar dari spora dan akhirnya basil dengan safranin dikontraskan. Fondasi ini berlaku untuk sisa teknik, di mana sesuatu yang serupa terjadi.
Teknik pewarnaan spora
Untuk membuat spora ternoda, Anda harus memiliki kultur murni strain tersangka yang ingin Anda pelajari.
Kultur tersebut mengalami suhu ekstrem selama 24 jam untuk menstimulasi mikroorganisme untuk bersporulasi. Untuk ini, biakan dapat ditempatkan dalam oven pada suhu 44 ° C atau di dalam lemari es (8 ° C) selama 24 atau 48 jam..
Jika terlalu banyak waktu tersisa pada suhu yang disebutkan, hanya eksospora yang akan diamati, karena semua endospora akan meninggalkan bacillus.
Pada akhir waktu, beberapa tetes larutan fisiologis steril harus ditempatkan pada slide yang bersih. Kemudian sebagian kecil dari hasil panen diambil dan penyebaran halus dilakukan.
Setelah itu dibiarkan kering, itu tetap pada panas dan diwarnai dengan beberapa teknik yang dijelaskan di bawah ini:
Teknik Dorner
1- Siapkan dalam tabung reaksi suspensi terkonsentrasi dari mikroorganisme berspor di dalam air suling dan tambahkan volume yang sama dari Kinyoun phenolic fuchsin.
2- Masukkan tabung ke dalam bak mandi dengan air mendidih selama 5 hingga 10 menit.
3- Pada slide yang bersih, campur setetes suspensi sebelumnya dengan setetes larutan nigrosin 10%, direbus dan disaring.
4- Perpanjang dan keringkan dengan cepat dengan panas ringan.
5- Periksa dengan objektif 100X (pencelupan).
Spora bernoda merah dan sel-sel bakteri tampak hampir tidak berwarna dengan latar belakang abu-abu gelap.
Teknik Dorner yang dimodifikasi
1- Suspensi mikroorganisme berspor tersebar pada slide dan dipaku pada panas.
2 - Sampel ditutupi dengan strip kertas saring yang ditambahkan fuchsin asam fenic. Pewarna dipanaskan selama 5 hingga 7 menit dengan nyala api pembakar Bunsen sampai pelepasan uap dihasilkan. Lalu kertas itu dibuang.
3 - Cuci persiapan dengan air dan kemudian keringkan dengan kertas penyerap.
4- Tutupi apusan dengan film tipis 10% nigrosin, menggunakan slide kedua untuk menyebarkan nigrosin atau jarum.
Warna yang diambil oleh spora dan bakteri adalah sama seperti yang dijelaskan dalam penemuan sebelumnya.
Teknik Shaeffer-Fulton atau Wirtz-Conklin
1- Buat penyebaran tipis dengan suspensi mikroorganisme berspora pada slide dan perbaiki agar memanas.
2- Tutup slide dengan larutan air hijau malachite 5% (kertas saring dapat ditempatkan pada lembaran).
3 - Panaskan api dari pembakar Bunsen untuk menyebabkan uap keluar dan menghilangkan api. Ulangi operasi selama 6 hingga 10 menit. Jika selama prosedur larutan hijau perunggu ini terlalu banyak menguap, lebih banyak yang dapat ditambahkan.
4- Lepaskan kertas saring (jika sudah dipasang) dan cuci dengan air.
5- Tutup slide dengan safranin encer 0,5% selama 30 detik (beberapa varian teknik ini menggunakan safranin encer 0,1% dan biarkan selama 3 menit).
Dengan teknik ini spora berwarna hijau dan basil berwarna merah.
Ini memiliki kelemahan bahwa endospora dari budaya muda tidak ternoda dengan baik, karena mereka terlihat sangat jernih atau tidak berwarna. Untuk menghindari hal ini, disarankan untuk menggunakan kultur inkubasi 48 jam.
Teknik Möeller
1- Tutupi apusan dengan kloroform selama 2 menit.
2- Buang kloroform.
3 - Tutupi dengan asam kromat 5% selama 5 menit.
4 - Cuci dengan air suling
5- Lembar ditutupi dengan ikan mas fuchsin-fenolik dan terkena nyala api pembakar Bunsen sampai emisi uap; kemudian dihapus dari api selama beberapa saat. Operasi diulangi hingga mencapai 10 menit.
6- Cuci dengan air.
7- Gunakan etanol yang diasamkan (alkohol hidroklorik) untuk menghilangkan warna. Itu dibiarkan selama 20 atau 30 detik.
8- Cuci dengan air suling.
9- Menangkal menutupi lembar dengan biru metilen selama 5 menit.
10- Cuci dengan air suling.
11- Biarkan kering dan sampel diambil di bawah mikroskop.
Spora tampak basil berwarna merah dan biru. Penting untuk tidak menghirup uap, karena mereka beracun dan dalam jangka panjang mereka bisa bersifat karsinogenik.
Teknik Möeller yang dimodifikasi tanpa panas
Pada 2007, Hayama dan rekan-rekannya menciptakan modifikasi teknik Möeller. Mereka menghilangkan langkah pemanasan pewarna dan menggantinya dengan penambahan 2 tetes surfaktan Tergitol 7 untuk setiap 10 ml larutan karbol fuchsin-fenolik. Hasil yang sama diperoleh.
Penggunaan
Pewarnaan spora memberikan informasi yang sangat berharga dan berguna untuk identifikasi patogen, karena keberadaan yang sama, bentuknya, lokasi dalam basil dan kemampuan untuk mengubah bentuk sel vegetatif atau tidak, adalah data yang dapat memandu spesies terlibat dalam gender tertentu.
Dalam konteks ini, perlu disebutkan bahwa spora dapat bulat atau oval, mereka dapat ditempatkan di tengah atau juga di posisi paracentral, subterminal atau terminal..
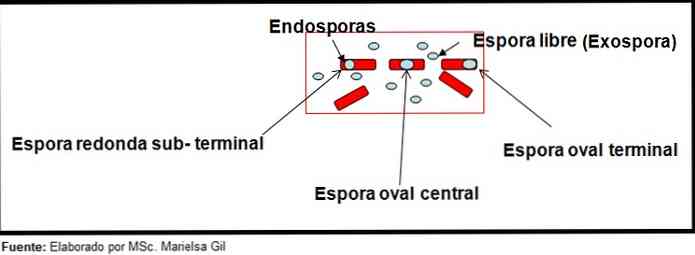
Contohnya
- Clostridium difficile membentuk spora oval di posisi terminal yang merusak bacillus.
- Spora Clostridium tertium Itu oval, tidak merusak bacillus dan terletak di tingkat terminal.
- Endospore dari Clostridium tetani itu adalah terminal dan merusak bacillus, memberikan penampilan stik drum.
- Spora Clostridium botulinum, C. histolyticum, C. November dan C. septicum mereka berbentuk oval bulat atau subterminal dan merusak bacillus.
- Endospore dari Clostridium sordelli terletak di posisi tengah, dengan sedikit deformasi.

Referensi
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Proposal teknik sederhana untuk pewarnaan spora bakteri tanpa menerapkan modifikasi metode Moeller yang sukses panas. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Kontributor Wikipedia. Noda Moeller. Wikipedia, Ensiklopedia Gratis. 3 November 2018, 03:28 UTC. Tersedia di: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Manual Laboratorium Teknik Mikrobiologi. Departemen Ilmu Dasar Akademi Mikrobiologi. Institut Politeknik Nasional.
- "Endospora." Wikipedia, Ensiklopedia gratis. 25 Feb 2018, 10:20 UTC. 10 Jan 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J dan kolaborator. (2006). Personil Tenaga Kerja dari Komunitas Otonom Extremadura. Agenda khusus Volume IV. Editorial MAD. Seville-Spanyol, hlm. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Teknisi laboratorium spesialis, dari Layanan Kesehatan Galician (SERGAS). Volume khusus materi pelajaran 2. Editorial MAD. Seville-Spanyol, hlm 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosis mikrobiologis. (Edisi ke-5). Argentina, Editorial Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnosis mikrobiologis dari Bailey & Scott. 12 ed. Argentina Editorial Panamericana S.A


