Formula Sodium sulfida, Penggunaan, Risiko
itu natrium sulfida (Na2S) adalah padatan kristal dari kuning ke merah bata. Di alam ia ditemukan dalam berbagai tingkat hidrasi, menjadi yang paling umum natrium sulfida nonahidrat (Na2S · 9H2O).
Mereka adalah garam yang larut dalam air yang memberikan solusi sangat basa. Ketika terpapar udara lembab, mereka menyerap uap air dari udara, yang secara spontan bisa memanas dan menyebabkan pengapian material yang mudah terbakar di sekitarnya. Demikian juga, jika kontak dengan udara lembab, mereka mengeluarkan hidrogen sulfida, yang baunya seperti telur busuk.

Mereka adalah agen pereduksi yang kuat. Zat-zat ini dapat berbahaya bagi lingkungan, terutama bagi organisme akuatik.
Sodium monosulfide tersedia secara komersial dalam bentuk serpih yang mengandung 60-62% Na2S ...
- Formula

- CAS: 1313-82-2 Sodium sulphide (anhydrous)
- CAS: 1313-84-4 Sodium sulfide (nonahydrated)
Struktur 2D
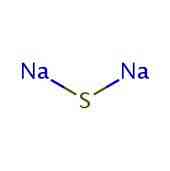
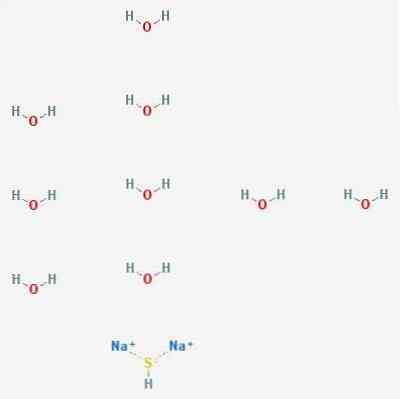
Struktur 3D
Karakteristik natrium sulfida
Sifat fisik dan kimia

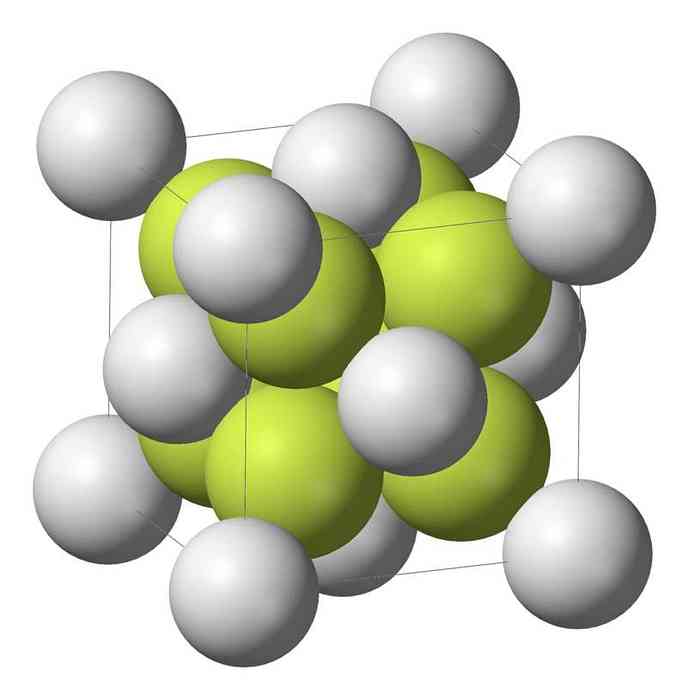
Sodium monosulfide (Na2S) mengkristal dengan struktur antifluorit, di mana setiap atom S dikelilingi oleh kubus 8 atom Na dan masing-masing atom Na dengan tetrahedral dari atom 4 S..
Kemudahan terbakar
Satu-satunya anggota yang sangat mudah terbakar dalam kelompok sulfida anorganik adalah hidrogen sulfida. Namun, beberapa sulfida anorganik lainnya, seperti natrium sulfida, dapat secara spontan memanas dan bahkan terbakar jika terkena uap air..
Ketika terpapar api, natrium sulfida mengeluarkan gas atau uap belerang dioksida, yang mengiritasi atau beracun.
Reaktivitas
- Sulfida anorganik umumnya basa (beberapa sangat basa, dan karena itu tidak sesuai dengan asam).
- Banyak dari senyawa ini adalah zat pereduksi (mereka bereaksi dengan kuat dengan zat pengoksidasi).
- Garam sulfida sederhana (seperti natrium, kalium dan amonium sulfida) bereaksi kuat dengan asam untuk melepaskan gas hidrogen sulfida yang sangat beracun dan mudah terbakar.
- Sodium sulfide mudah terbakar. Dapat meledak saat dipanaskan dengan cepat atau kena.
- Ketika dipanaskan hingga terurai, ia mengeluarkan uap beracun natrium oksida dan sulfur oksida.
- Bereaksi hebat dengan karbon, dengan arang, garam diazonium, N, N-diklorometilamin, oksidan kuat, dan air.
Toksisitas
Banyak anggota kelompok sulfida anorganik berperilaku sebagai basa kuat, dan dapat menyebabkan luka bakar parah ketika kontak dengan kulit..
Properti ini tergantung pada kelarutannya. Sulfida anorganik yang paling tidak larut (misalnya, merkuri (II) sulfida dan kadmium sulfida) tidak bersifat kaustik.
Sodium sulfida memiliki medium octanol / koefisien partisi air (Pow) (-3,5). Nilai ini digunakan sebagai ukuran kelarutan (dan biokonsentrasi) suatu zat dalam jaringan lemak hewan (terutama hewan air).
Sodium sulfida dianggap berbahaya bagi lingkungan, terutama untuk organisme akuatik.
Penggunaan
Di rumah, natrium sulfida digunakan dalam membuka pipa, pembersih rumah tangga (untuk tungku, kamar mandi), pelurus rambut, sabun cuci piring dan kantong udara otomatis.
Dalam industri, digunakan dalam pembersih, semen, dan sebagai pendahulu dalam produksi produk kimia lainnya.
Efek klinis
Paparan natrium sulfida umum terjadi di negara-negara maju dan negara-negara terbelakang, baik di industri maupun di rumah. Zat korosif ini hadir dalam beberapa produk rumah tangga dalam konsentrasi rendah.
Di negara maju, efek serius jarang terjadi. Ini terjadi terutama karena konsumsi bahan kimia yang disengaja pada orang dewasa. Namun, di negara-negara berkembang, efek serius lebih sering terjadi.
Korosi alkali menyebabkan nekrosis karena pencairan. Menyabuni lemak dalam membran sel, menghancurkan sel dan memungkinkan penetrasi yang dalam ke jaringan selaput lendir.
Paparan oral
Peradangan awal terjadi pada jaringan pencernaan, diikuti oleh nekrosis jaringan (dengan kemungkinan perforasi), kemudian granulasi dan akhirnya pembentukan stenosis..
Pasien dengan konsumsi ringan mengalami iritasi atau luka bakar tingkat I (hiperemia dan edema superfisial) pada orofaring, esofagus atau lambung..
Pasien dengan intoksikasi sedang dapat mengalami luka bakar derajat II (lepuh superfisial, erosi dan ulserasi) dengan kemungkinan pembentukan stenosis lebih lanjut (terutama kerongkongan).
Beberapa pasien (terutama anak kecil) dapat mengalami edema pada saluran pernapasan bagian atas.
Pasien dengan keracunan parah dengan menelan dapat mengembangkan luka bakar yang dalam dan nekrosis pada mukosa gastrointestinal, dengan komplikasi seperti: perforasi (kerongkongan, lambung, jarang duodenal), pembentukan fistula (trakeo-esofagal, aortoofofagus) dan perdarahan gastrointestinal.
Mereka dapat berkembang: hipotensi, takikardia, takipnea, pembentukan striktur (terutama kerongkongan), karsinoma esofagus, dan edema pada saluran pernapasan bagian atas (yang umum dan sering mengancam jiwa).
Keracunan parah umumnya terbatas pada asupan yang disengaja pada orang dewasa.
Pemaparan melalui penghirupan
Paparan ringan dapat menyebabkan batuk dan bronkospasme.
Inhalasi parah dapat menyebabkan edema saluran pernapasan bagian atas, luka bakar, stridor, dan, jarang, cedera paru akut.
Paparan mata
Ini dapat menghasilkan iritasi konjungtiva dan kemosis yang parah, cacat epitel kornea, iskemia limbik, kehilangan penglihatan permanen dan pada kasus perforasi yang parah..
Paparan kulit
Paparan ringan menyebabkan iritasi dan luka bakar ketebalan sebagian. Asidosis metabolik dapat terjadi pada pasien dengan luka bakar atau syok yang parah.
Pemaparan dalam waktu lama atau produk konsentrasi tinggi dapat menyebabkan luka bakar ketebalan total.
Keamanan dan Risiko
Pernyataan Bahaya Sistem Global Harmonisasi untuk Klasifikasi dan Pelabelan Bahan Kimia (SGA)
Sistem Klasifikasi dan Pelabelan Bahan Kimia Harmonisasi Global (SGA) adalah sistem yang disepakati secara internasional, dibuat oleh Perserikatan Bangsa-Bangsa dan dirancang untuk menggantikan berbagai klasifikasi dan standar pelabelan yang digunakan di berbagai negara dengan menggunakan kriteria yang konsisten di seluruh dunia.
Kelas bahaya (dan bab GHS yang sesuai), standar klasifikasi dan pelabelan, dan rekomendasi untuk natrium sulfida adalah sebagai berikut (Badan Bahan Kimia Eropa, 2017, PBB, 2015, PubChem, 2017):







Referensi
- Benjah-bmm27, (2006). Fluorite-unit-cell-3D-ionic [image] Diperoleh dari: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [gambar] Diperoleh dari: chem.nlm.nih.gov.
- ChemIDplus, (2017). Struktur 3D 1313-82-2 - Sodium sulfide [image] Diperoleh dari: chem.nlm.nih.gov.
- ChemIDplus, (2017). Struktur 3D 1313-84-4 - Sodium sulfide [image] Diperoleh dari: chem.nlm.nih.gov.
- Badan Bahan Kimia Eropa (ECHA). (2017). Ringkasan Klasifikasi dan Pelabelan.
- Klasifikasi yang harmonis - Lampiran VI Peraturan (EC) No 1272/2008 (Peraturan CLP). Sodium sulfida. Diperoleh pada 16 Januari 2017, dari: echa.europa.eu.
- Badan Bahan Kimia Eropa (ECHA). (2017). Ringkasan Klasifikasi dan Pelabelan.
- Klasifikasi dan pelabelan yang diberitahukan. Sodium sulfida, terhidrasi. Diperoleh pada 16 Januari 2017, dari: echa.europa.eu.
- Bank Data Zat Berbahaya (HSDB). TOXNET (2017). Sodium sulfid. Bethesda, MD, EU: Perpustakaan Kedokteran Nasional. Diperoleh dari: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Sulfida, Polisulfida, dan Sulfan. Dalam Ensiklopedia Kimia Industri Ullmann. Wiley-VCH Verlag GmbH & Co. KGaA. Diperoleh dari dx.doi.org.
- Perserikatan Bangsa-Bangsa (2015). Sistem Harmonisasi Global untuk Klasifikasi dan Pelabelan Produk Kimia (SGA) Edisi Revisi Keenam. New York, Amerika Serikat: Publikasi PBB. Diperoleh dari: unece.org.
- Pusat Nasional untuk Informasi Bioteknologi. Basis Data Gabungan PubChem. (2016). Sodium Sulfide enneahydrate - Struktur PubChem [image] Diperoleh dari: pubchem.ncbi.nlm.nih.gov.
- Pusat Nasional untuk Informasi Bioteknologi. Basis Data Gabungan PubChem. (2017). Sodium monosulfide. Bethesda, MD, EU: Perpustakaan Kedokteran Nasional. Diperoleh dari: pubchem.ncbi.nlm.nih.gov.
- Pusat Nasional untuk Informasi Bioteknologi. Basis Data Gabungan PubChem. (2017). Sodium Sulfide enneahydrate. Bethesda, MD, EU: Perpustakaan Kedokteran Nasional. Diperoleh dari: pubchem.ncbi.nlm.nih.gov.
- Administrasi Kelautan dan Atmosfer Nasional (NOAA). Bahan Kimia CAMEO. (2017). Lembar Data Kimia. Sodium sulfide, anhidrat. Silver Spring, MD. UE; Diperoleh dari: cameochemicals.noaa.gov.
- Administrasi Kelautan dan Atmosfer Nasional (NOAA). Bahan Kimia CAMEO. (2017). Lembar Data Grup yang Reaktif. Sulfida, Anorganik. Silver Spring, MD. UE; Diperoleh dari: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Diperoleh dari: wikipedia.org.
- PubChem, (2016). Sodium monosulfide [image] Diperoleh dari: puchem.nlm.nih.gov.
- PubChem, (2016). Sodium Sulfide enneahydrate [image] Diperoleh dari: puchem.nlm.nih.gov.
- Wikipedia. (2017). Koefisien partisi oktanol-air. Diperoleh 17 Januari 2017, dari: wikipedia.org.
- Wikipedia. (2017). Sodium sulfida. Diperoleh 17 Januari 2017, dari: wikipedia.org.


