Properti, Risiko, dan Penggunaan Iron sulfide (II)
itu besi sulfida (II), juga disebut ferrous sulfide, adalah senyawa kimia formula FeS. Serbuk besi sulfida bersifat piroforik (terbakar secara spontan di udara).
Sulfida besi (II) diperoleh dengan memanaskan belerang dan besi sesuai dengan reaksi:
Fe + S → FeS
Reaksi ini sangat eksotermik (melepaskan panas) dan rasio antara besi dan belerang harus 7: 4 (NileRed, 2014).
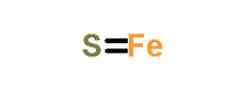
Ferro sulfida juga dapat diperoleh dalam media berair dengan melarutkan sulfur dalam larutan besi ionik (II). Belerang, ketika dilarutkan, membentuk hidrogen sulfida yang bereaksi secara reversibel dengan ion besi (II) sesuai dengan reaksi
Iman2+ + H2S FeS (s) + 2H+
Namun, reaksi ini bersaing dengan reaksi pembentukan asam sulfat besi (II) dengan cara berikut:
Iman2+ + 2HS- → Fe (HS)2(s)
Selanjutnya besi (II) asam sulfat didekomposisi menjadi ferro sulfat, meskipun reaksinya terjadi sangat lambat (Rickard, 1995).
Indeks
- 1 Sifat fisik dan kimia
- 2 Reaktivitas dan bahaya
- 3 Penanganan dan penyimpanan
- 4 Penggunaan
- 5 Referensi
Sifat fisik dan kimia
Besi (II) sulfida adalah benda padat berwarna coklat gelap atau hitam. Ketika murni itu tidak berwarna (Pusat Nasional untuk Informasi Bioteknologi, S.F). Gambar 2 menggambarkan penampilan ferrous sulfide.

Senyawa ini memiliki berat molekul 87,910 g / mol dan kepadatan 4,84 g / ml. Memiliki titik leleh 1195 ° C dan tidak larut dalam air dan asam nitrat (Royal Society of Chemistry, 2015).
Ferrous sulfide bereaksi dalam media asam untuk membentuk ferrous oxide dan uap hidrogen sulfida yang sangat beracun. Ini diamati dalam reaksi berikut:
FeS + 2H+ → Iman2+ + H2S
Bereaksi dengan larutan asam sulfat encer untuk membentuk ferro oksida, sulfur dioksida dan air sesuai dengan reaksi:
FeS + H2SO4 → FeO + H2O + SO2
Reaktivitas dan bahaya
Ferrous sulfide adalah senyawa yang tidak stabil dan bereaksi dengan udara untuk membentuk ferrous oxide dan sulfur. Senyawa ini bersifat piroforik dan dapat menyala secara spontan atau juga produk dari dampak yang kuat, sehingga tidak disarankan untuk menggilingnya dalam mortar ketika disintesis dan harus diperlakukan dengan hati-hati..
Bereaksi dengan zat pengoksidasi dan ketika dekomposisi yang dipanaskan memancarkan uap beracun dari sulfur oksida. Senyawa ini sangat berbahaya jika tertelan dan berbahaya jika terjadi kontak dengan mata (mengiritasi) dan terhirup (Lembar Data Keselamatan Bahan Ferrous sulfide, 2013).
Dalam kasus kontak dengan mata, ini harus dibilas dengan banyak air selama setidaknya 15 menit, kadang-kadang mengangkat kelopak mata atas dan bawah.
Jika senyawa itu bersentuhan dengan kulit, ia harus dibilas dengan banyak air selama minimal 15 menit sambil melepaskan pakaian dan sepatu yang terkontaminasi..
Jika tertelan, jika korban sadar dan waspada, ia harus diberi 2-4 gelas susu atau air. Jangan pernah memberikan apapun melalui mulut kepada orang yang tidak sadar
Jika terhirup, korban harus dipindahkan dari tempat paparan dan dipindahkan ke tempat yang dingin. Jika tidak bernapas, pernapasan buatan harus diberikan. Jika sulit bernafas, oksigen harus diberikan.
Dalam semua kasus, perhatian medis segera harus diperoleh (fisher scientific, 2009).
Iron sulfide terlibat dalam kondisi jinak langka yang dikenal sebagai pseudomelanosis duodeni. Ini bermanifestasi secara endoskopi sebagai diskrit, datar, bercak hitam-coklat pada mukosa duodenum.
Itu tidak menghasilkan gejala dan dapat dibalik. Dengan mikroskop elektron dan analisis sinar-X dari dispersi energi dengan probe elektron, pigmen tersebut terutama berkaitan dengan akumulasi ferrous sulfide (FeS) dalam makrofag dalam lamina propria (Cheng CL, 2000).
Penanganan dan penyimpanan
Ferro sulfida harus dijauhkan dari panas dan sumber nyala. Wadah kosong merupakan risiko kebakaran, limbah harus diuapkan di bawah kap ekstraktor. Tanah semua peralatan yang mengandung bahan untuk menghindari percikan listrik.
Jangan menghirup debu. Hindari kontak dengan mata. Pakailah pakaian pelindung yang cocok. Jika ventilasi tidak memadai, pakai peralatan pernapasan yang sesuai.
Jika Anda merasa tidak enak badan, Anda harus mencari perhatian medis dan menunjukkan label produk sebanyak mungkin. Senyawa harus dijauhkan dari zat yang tidak cocok seperti zat pengoksidasi dan asam.
Wadah berisi senyawa harus dijaga tetap kering di tempat yang dingin. Dan itu harus ditutup kedap udara di tempat yang berventilasi. Bahan yang mudah terbakar harus disimpan jauh dari panas ekstrem dan jauh dari zat pengoksidasi kuat.
Penggunaan
Iron sulfide digunakan dalam industri paduan dan stainless steel untuk mengontrol embrittlement hidrogen. Industri besi dan baja menggunakan besi sulfida sebagai agen re-sulfurisasi dalam pembuatan baja cutting bebas-baja, alloy dan stainless steel.
Itu juga bertindak sebagai agen merendahkan untuk meningkatkan kapasitas mesin pengecoran baja, yang digunakan dalam produksi berbagai bagian baja. Dalam pemurnian asam fosfat kasar, besi sulfida digunakan sebagai zat pereduksi untuk menghilangkan kotoran berat dari asam fosfat..
Penggunaan lain dari besi sulfida adalah dalam produksi besi lunak. Iron sulfide yang dikombinasikan dengan ferrous silicon dan ferromanganese digunakan untuk meningkatkan kandungan sulfur baja dan besi.
Iron sulfide juga digunakan sebagai bahan kimia laboratorium untuk persiapan gas hidrogen sulfida. Dalam pewarna rambut, cat, keramik, botol dan gelas, besi sulfida digunakan sebagai pigmen. Itu juga digunakan dalam pelumas dan untuk mengobati gas buang.
Iron sulfide memiliki kegunaan yang kompatibel dengan sulfat. Senyawa sulfat larut dalam air dan digunakan dalam pengolahan air. Iron sulfide juga digunakan dalam produksi pengecoran logam.
Iron sulfide adalah mineral pirit yang menyerupai emas dan dijuluki sebagai "emas orang bodoh". Pirit digunakan dalam produksi sulfur dan asam sulfat dan juga digunakan dalam penambangan batubara (JAINSON LABS (INDIA), S.F.).
Referensi
- Cheng CL, e. a. (2000). Pseudomelanosis duodeni: laporan kasus. Changgeng Yi Xue Za Zhi 23 (6), 372-376.
- nelayan ilmiah (2009, 20 Agustus). Lembar Data Keselamatan Bahan Besi (II) Sulfida. Diperoleh dari lasecsa.
- JAINSON LABS (INDIA). (S.F.). Penggunaan Ferrous Sulphide. Diperoleh dari jainsonfes.
- Lembar Data Keselamatan Bahan Ferrous sulfide. (2013, 21 Mei). Diperoleh dari sciencelab.
- Pusat Nasional untuk Informasi Bioteknologi. (S.F.). Basis Data Gabungan PubChem; CID = 14828. Diperoleh dari PubChem.
- (2014, 15 Mei). Mempersiapkan Besi (II) Sulfida (reaksi dingin). Diperoleh dari youtube.
- Rickard, D. (1995). Kinetika presipitasi FeS: Bagian 1. Mekanisme reaksi yang bersaing. Geochimica et Cosmochimica Acta Volume 59, Edisi 21, 4367-4379.
- Royal Society of Chemistry. (2015). Besi (II) sulfida. Diperoleh dari chemspider: chemspider.com.


