Karakteristik Solut, Perbedaan dengan Solute dan Solvent, Contohnya
itu terlarut, dalam suatu solusi,itu adalah zat yang larut dalam pelarut. Umumnya, zat terlarut ditemukan dalam proporsi yang lebih rendah, dan dapat menjadi padat, cair atau gas. Sebaliknya, pelarut adalah komponen larutan yang jumlahnya lebih banyak.
Misalnya, dalam air garam, garam adalah zat terlarut dan air adalah pelarut. Namun, tidak semua zat terlarut bersifat padat atau pelarut berbentuk cair.

Dalam pengertian ini, ada beberapa kemungkinan kombinasi zat terlarut dan pelarut: gas dalam cairan, gas dalam padatan, cair dalam cairan, cair dalam padatan, padatan dalam cairan atau padatan dalam padatan.
Untuk mengenali zat terlarut yang ada dalam solusi, dua aspek harus dipertimbangkan. Pertama, zat terlarut adalah zat yang dalam proporsi lebih kecil. Selain itu, itu adalah salah satu yang mengubah keadaan fisiknya (padat, cair atau gas) ketika diintegrasikan ke dalam larutan.
Indeks
- 1 Solusi, pelarut dan zat terlarut
- 2 Definisi zat terlarut
- 3 Karakteristik
- 3.1 Kelarutan
- 3.2 Temperatur
- 3.3 Kejenuhan suatu solusi
- 3.4 Tekanan
- 3.5 Polaritas
- 4 Perbedaan antara zat terlarut dan pelarut
- 5 Contoh zat terlarut
- 5.1 Solutos dalam keadaan gas
- 5.2 Solutos dalam kondisi padat
- 5.3 Solutos dalam keadaan cair
- 5.4 Solutos yang dapat digunakan di rumah
- 6 Referensi
Solusi, pelarut dan zat terlarut
Dalam kimia ada campuran homogen, yaitu mereka yang memiliki komponennya dibagi menjadi proporsi yang sama melalui konten mereka. Salah satu jenis campuran homogen yang paling umum adalah larutan, yang merupakan campuran homogen yang stabil dari dua atau lebih zat, di mana zat terlarut larut dalam pelarut..
Solusi, pelarut dan zat terlarut diamati dalam situasi sehari-hari dan dalam kisaran yang bervariasi dari industri ke laboratorium. Zat-zat ini terbentuk dari campuran adalah objek penelitian karena karakteristik yang mereka sajikan dan kekuatan dan / atau atraksi yang terjadi di antara mereka..
Definisi zat terlarut
Seperti disebutkan di atas, zat terlarut adalah zat yang larut menjadi zat lain, yang disebut pelarut.
Biasanya zat terlarut memiliki proporsi yang lebih kecil dan dapat terjadi di salah satu dari tiga keadaan materi. Ketika solusi diberikan antara dua zat yang berada dalam fase yang sama, metode pemilihan yang dalam proporsi yang lebih kecil digunakan untuk menentukan mana yang terlarut dan mana yang merupakan pelarut..
Kapasitas pembubaran zat terlarut akan diatur oleh kelarutannya. Suhu pelarut juga merupakan faktor penentu ketika datang untuk mengetahui kemungkinan membentuk atau tidak solusi, karena semakin tinggi suhu pelarut, semakin besar jumlah zat terlarut yang dapat dilarutkan dalam.
Ada zat yang disebut surfaktan yang menjadi kurang larut pada suhu tinggi, tetapi mereka adalah pengecualian dan memenuhi peran tertentu.
Proses di mana pelarut berinteraksi dengan zat terlarut untuk membentuk solusi didefinisikan sebagai pelarut, dan melibatkan pembentukan ikatan dan jembatan hidrogen, di samping atraksi oleh pasukan van der Waals.
Fitur
Zat terlarut terdiri dari berbagai macam zat kimia di berbagai negara, memiliki kapasitas disolusi yang berbeda dan memiliki banyak karakteristik yang memainkan peran penting dalam pembentukan campuran homogen. Beberapa karakteristik utama zat terlarut adalah sebagai berikut:
Kelarutan
Kelarutan adalah kemampuan suatu senyawa untuk larut dalam zat lain. Kemampuan ini memiliki hubungan dekat dengan kemampuan bercampur, yang merupakan kemampuan cairan untuk bercampur dengan yang spesifik; Jika Anda tidak dapat bergabung, itu adalah ketidakmungkinan.
Kemampuan tersebut memiliki jangkauan lebih dari jumlah tertentu, sehingga dapat dikatakan bahwa satu zat sepenuhnya, sebagian atau tidak larut dalam zat lain..
Sifat terlarut dari zat terlarut pada gilirannya tergantung pada faktor-faktor lain yang dapat menambah atau mengurangi kapasitas ini karena efek ini pada keseimbangan gaya antarmolekul yang diciptakan antara zat terlarut dan pelarut.
Bahkan fitur yang kurang diharapkan, seperti ukuran setetes zat terlarut atau urutan dalam struktur kristal, dapat mempengaruhi kemampuan mereka untuk larut.
Suhu
Suhu sistem di mana zat terlarut dapat mempengaruhi kelarutannya: untuk sebagian besar zat padat dan cairan, ini meningkatkan kapasitas disolusi sesuai dengan kenaikan suhu.
Sebaliknya, dalam gas, perilaku kompleks diamati yang ditunjukkan sebagai kelarutan yang lebih rendah dalam air pada suhu yang lebih tinggi, tetapi lebih besar dalam pelarut organik..
Kejenuhan suatu solusi
Ini disebut saturasi larutan sampai pada tingkat di mana suatu larutan telah melarutkan zat terlarut, disebut larutan jenuh terhadap larutan yang telah larut sebanyak mungkin zat terlarut. Dari titik ini, zat terlarut yang ditambahkan akan mengendap sebagai kelebihan di bagian bawah wadah bekas; sebelum ini, solusinya disebut tak jenuh.
Dimungkinkan untuk melewati titik jenuh dan terus melarutkan zat terlarut, tetapi ini membutuhkan peningkatan suhu. Suatu larutan yang mengandung zat terlarut berlebih dan yang telah dipanaskan disebut larutan jenuh.
Tekanan
Perubahan tekanan biasanya tidak mempengaruhi kelarutan padatan dan cairan, terlepas dari beberapa kasus luar biasa (akumulasi kalsium sulfat dalam pipa minyak bumi), tetapi dalam gas itu merupakan faktor penentu kemampuan mereka untuk larut.
Faktanya, kelarutan gas dalam pelarut berbanding lurus dengan tekanan parsial gas tersebut pada pelarut tersebut..
Polaritas
Polaritas zat terlarut sangat penting ketika mengukur kapasitas pembubarannya; zat terlarut akan larut lebih baik dalam pelarut dengan struktur kimia yang mirip dengan yang dimilikinya.
Sebagai contoh, zat yang sangat polar atau hidrofilik akan memiliki kelarutan yang lebih besar dalam pelarut yang sangat polar, sementara mereka praktis tidak akan larut dalam zat non-polar..
Demikian pula, gaya antarmolekul memainkan peran penting dalam solvasi dan kemudahan pelarut dapat melarutkan zat terlarut: semakin besar gaya dipol-dipol, ikatan hidrogen dan ikatan lainnya, semakin besar kemampuan pelarut untuk larut solut dan membentuk solusi.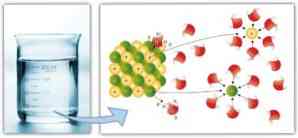
Perbedaan antara zat terlarut dan pelarut
- Zat terlarut adalah zat yang larut; pelarut adalah cara untuk melarutkan zat terlarut.
- Zat terlarut bisa dalam fase padat, cair atau gas; pelarut biasanya dalam fase cair, tetapi juga ada dalam bentuk padat dan gas.
- Kelarutan zat terlarut lebih tergantung pada sifat-sifat seperti permukaan; Kapasitas solvat tergantung pada polaritas, suhu dan tekanan, di antara faktor-faktor lain.
- Zat terlarut biasanya komponen yang diinginkan untuk diekstraksi dalam proses industri; Pelarut biasanya bukan komponen yang diinginkan dan dibuang dalam proses industri.
Contoh zat terlarut
- Gula adalah contoh zat terlarut fase padat, biasanya digunakan untuk mempermanis air.
- Heksana dapat ditemukan dalam lilin parafin, berfungsi sebagai zat terlarut cair yang membuat padatan ini lebih mudah dibentuk.
- Karbon dioksida adalah gas yang ditambahkan ke minuman untuk memberi mereka semangat.
Solutos dalam kondisi gas
Karbon dioksida dalam air (minuman ringan)
Air karbonik adalah air yang mengandung karbon dioksida dan diproduksi dengan melewatkan karbon dioksida di bawah tekanan melalui air.
Air mineral berkarbonasi terjadi secara alami untuk waktu yang lama. Perairan berbuih ini ada karena kelebihan karbon dioksida dalam akuifer yang telah larut di bawah tekanan.
Salah satu contoh zat terlarut yang paling terkenal adalah minuman ringan komersial, yang dikombinasikan dengan sirup.
Kehadiran karbon dioksida membuat air dan minuman ringan ini lebih membangkitkan selera dan menarik secara visual.
Oksigen dan gas lainnya dalam nitrogen (udara)
Udara di atmosfer terdiri dari molekul gas yang berbeda. Ini pada dasarnya terdiri dari 78% nitrogen dan sekitar 21% oksigen (terlarut). Selain itu, mengandung hampir 1% dari argon dan molekul lain, tetapi dalam jumlah yang sangat kecil.
Propana dalam butana (gas memasak)
Kombinasi ini, juga dikenal sebagai gas minyak cair (LPG), mulai digunakan sejak 1860 sebagai sumber bahan bakar untuk keperluan rumah tangga..
Sejak itu ia telah memperluas produksi dan konsumsinya untuk keperluan domestik dan industri. Karena kedua gas ini sangat tidak berbau dan berbahaya, zat yang disebut mercaptan, yang membuat kebocoran dapat dilihat, ditambahkan..
Solutos dalam kondisi padat
Seng tembaga (kuningan)
Paduan komersial yang dikenal sebagai kuningan dibentuk oleh seng (dari 5 hingga 40%) yang dilarutkan dalam tembaga. Seng membantu meningkatkan kekuatan tarik. Elemen lain seperti timah, besi, aluminium, nikel dan silikon dapat ditambahkan ke paduan ini.
Yodium dalam alkohol (tingtur yodium)
Contoh lain dari zat terlarut yang dikenal adalah tingtur yodium. Solusi ini mengandung iodin dalam etil alkohol (dari 44 hingga 50%). Tingtur yodium digunakan sebagai antiseptik.
Garam dalam air (air laut)
Air laut menutupi lebih dari 70% permukaan bumi. Ini adalah campuran kompleks dari 96,5% air, 2,5% garam dan jumlah zat lain yang lebih sedikit. Ini termasuk bahan organik anorganik dan terlarut, partikel dan beberapa gas atmosfer.
Solutos dalam keadaan cair
Alkohol dalam air (minuman beralkohol)
Etanol atau etil alkohol (zat terlarut) dari fermentasi gula dicampur dengan air dalam proporsi tetap untuk menghasilkan minuman beralkohol.
Senyawa ini mudah dicerna oleh tubuh, tetapi konsumsinya secara berlebihan dapat menyebabkan kerusakan kesehatan yang serius.
Air di udara (kelembaban di udara)
Air di udara umumnya dikenal sebagai kabut. Ini disebabkan oleh tetesan kecil air yang menggantung di udara, dan pada dasarnya disebabkan oleh pendinginan bumi pada malam hari.
Dengan cara ini, pendinginan ini menyebabkan udara di sekitarnya menurunkan suhunya. Kemudian, fenomena tersebut terjadi ketika air yang terkondensasi tertahan di dalamnya.
Asam asetat dalam air (cuka)
Cuka adalah cairan dengan rasa tajam yang digunakan untuk menambah rasa atau mengawetkan makanan. Itu dibuat oleh larutan asam asetat dicampur dengan air.
Konsentrasi asam asetat bervariasi. Misalnya, cuka suling memiliki proporsi yang berkisar dari 5 hingga 8%.
Merkuri dalam warna perak (amalgam atau tambalan gigi)
Amalgam yang digunakan untuk tambalan gigi dibentuk oleh merkuri 2% dengan paduan yang bertindak sebagai pelarut. Paduan ini mengandung 70% perak. Anda juga bisa menambahkan timah, tembaga, dan seng.
Solutos itu bisa digunakan di rumah
Gula dalam air
Gula adalah senyawa molekul dan polar, dan karena itu memiliki kemampuan untuk larut dalam air, yang juga merupakan elemen kutub.
Cara di mana gula terstruktur akan menyebabkan proses pembubaran bervariasi. Sebagai contoh, jika gula ada dalam benjolan, akan membutuhkan lebih banyak waktu untuk larut daripada jika dalam bentuk biji-bijian.
Beberapa ahli percaya bahwa air dengan gula adalah sumber energi yang sangat penting bagi tubuh. Bahkan ada penelitian yang mengungkap keefektifan solusi ini pada orang yang melakukan aktivitas fisik.
Gula dalam tepung
Adalah umum untuk persiapan kue untuk mencampur bahan padat terlebih dahulu, kemudian tambahkan cairan.
Gula adalah zat terlarut yang melekat pada tepung, sehingga menimbulkan campuran basa untuk kue. Selain dua bahan ini, yang lain ditambahkan kemudian, seperti telur, mentega atau vanila.
Jenis zat terlarut ini padat dan, dalam hal ini, dicampur dengan pelarut yang juga padat. Basis yang dihasilkan juga dapat digunakan untuk membuat roti manis, kue, kue, kue bolu, puding kecil dan banyak makanan manis lainnya.
Bubuk jus dalam air
Ada berbagai macam jus bubuk yang disiapkan dengan melarutkan unsur ini dalam air. Dalam hal ini zat terlarut adalah bubuk jus dan pelarutnya adalah air.
Jumlah pelarut harus lebih besar dari yang terlarut, jadi biasanya satu atau dua sendok makan bubuk jus dilarutkan dalam segelas air. Bahkan, ada beberapa bubuk yang konsentrasinya lebih tinggi dan jumlah yang lebih kecil harus digunakan.
Ada pencela jus ini, karena mereka menunjukkan bahwa komponen yang mereka masukkan (sebagai pengawet, penstabil, dan pemanis, antara lain) berbahaya bagi kesehatan.
Klorin dalam air
Salah satu cara untuk memurnikan air adalah dengan menggunakan klorin sebagai zat terlarut dalam air. Disinfektan ini dicirikan sebagai salah satu yang paling banyak digunakan untuk menghilangkan mikroba, dan sangat ideal untuk mengubah air yang tidak dapat diminum menjadi dapat diminum dengan cara yang cepat, ekonomis dan mudah..
Klorin sebagai zat terlarut dari larutan ini harus dimasukkan ke dalam air pada konsentrasi tidak lebih tinggi dari 0,2 dan 0,5 miligram per liter.
Jumlah klorin yang digunakan harus sangat rendah, karena zat ini bisa sangat beracun ketika dikonsumsi atau terpapar dalam jumlah banyak.
Metode pemurnian air ini dikenal sebagai klorinasi, dan dapat diterapkan di tengah perjalanan ke gunung atau untuk mengolah air di rumah, untuk menghilangkan bakteri dan mikroba yang dapat ditemukan di pipa yang dilewati air..
Melukis dalam air
Air adalah pelarut paling universal yang ada, dan juga merupakan dasar di mana zat terlarut seperti cat dapat larut.
Cat biasanya larut karena berbagai alasan. Yang paling umum adalah memfasilitasi pembersihan kuas dan alat lain yang digunakan untuk melukis.
Ada banyak jenis lukisan; Yang paling larut dalam air adalah yang lateks. Selain memungkinkan pembersihan alat yang lebih baik, keuntungan dari pengenceran cat dalam air sebelum mulai mengecat adalah bahwa hal itu akan menjamin hasil akhir yang lebih baik pada permukaan yang dicat..
Susu bubuk dalam air
Susu bubuk adalah zat terlarut yang terbentuk melalui dehidrasi susu yang sudah dipasteurisasi. Tujuan dari proses ini adalah untuk memastikan bahwa susu dapat disimpan lebih baik lebih lama.
Larutan ini larut dalam air dan menghasilkan susu cair yang biasanya dikonsumsi saat sarapan, bersama dengan kopi atau dalam berbagai persiapan.
Seperti dalam kasus bubuk jus, jumlah susu yang akan diencerkan harus lebih sedikit dari jumlah air yang ingin Anda siapkan solusinya..
Deterjen dalam air
Saat mencuci pakaian, deterjen cair atau bubuk digunakan. Ini dilarutkan dalam air untuk membentuk solusi yang bertindak sebagai disinfektan dan pembersih kain tekstil.
Jumlah zat terlarut yang harus digunakan dalam larutan ini adalah variabel, tergantung pada jenis deterjen, penyajian yang sama dan komponen yang dimilikinya..
Solusi yang terdiri dari deterjen dan air dapat sangat mencemari ketika bersentuhan dengan tempat pembuangan air, sehingga disarankan untuk menggunakan deterjen yang dapat terurai secara hayati, yang dapat terdegradasi dalam waktu yang sangat singkat dan berdampak lebih sedikit terhadap lingkungan.
Gelatin
Gelatin adalah elemen yang terdiri dari tendon, ligamen, dan tulang hewan. Senyawa ini bisa dalam bentuk bubuk atau lembaran.
Dalam kedua kasus, zat terlarut ini harus dilarutkan dalam air panas untuk mencapai hasil akhir: makanan manis yang ideal untuk hidangan penutup dan dengan banyak manfaat kesehatan.
Di antara manfaat senyawa ini adalah ia lebih menyukai perbaikan jaringan yang cepat dan merupakan makanan anti-inflamasi. Selain itu, ia memiliki sejumlah besar protein dan memainkan peran penting dalam fortifikasi sistem kekebalan tubuh.
Makan sedikit gelatin setiap hari akan membantu meregenerasi sendi dan dengan demikian mengantisipasi munculnya osteoporosis.
Cokelat dalam susu
Cokelat adalah unsur yang terbentuk berkat campuran cocoa dan cocoa butter. Makanan ini berfungsi sebagai zat terlarut saat dicampur dengan susu untuk menyiapkan apa yang dikenal sebagai cokelat panas.
Untuk persiapan ini, jumlah susu yang diinginkan dipanaskan dan cokelat ditambahkan, dalam bentuk potongan, dalam bentuk bubuk atau cairan, secara konstan diaduk.
Agar zat terlarut ini larut dengan cara terbaik dan menghindari benjolan perlu untuk mengalahkan campuran tanpa jeda.
Bubuk kakao dalam air
Anda juga bisa menyiapkan cokelat panas menggunakan bubuk kakao. Larutan ini terbentuk hanya oleh massa bubuk kakao. Tidak seperti cokelat, kakao tidak termasuk mentega buah ini.
Kakao dapat larut sempurna dalam air untuk menghasilkan minuman rasa cokelat. Dalam hal ini penting untuk memaniskan campuran dengan gula, madu atau pemanis; jika tidak hasilnya akan sangat pahit.
Referensi
- Lambert, N. dan Mohammed, M. (1993). Kimia untuk CXC. Oxford: Heinemann.
- Steen, D. P. (2008). Karbon dioksida, karbonasi, dan prinsip-prinsip teknologi pengisian. Dalam D. P. Steen, Philip dan P. R. Ashurst (editor), Minuman Ringan Berkarbonasi: Formulasi dan Pembuatan, hlm. 112-143. Oxford: Penerbitan Blackwell.
- Apa yang ada di Udara? (s / f). Pusat Pendidikan Sains UCAR. Diperoleh pada 17 Oktober 2017, dari eo.ucar.edu
- Gas minyak cair. (2013, 12 Juli). Encyclopædia Britannica.
Diperoleh pada 16 Oktober 2017, dari britannica.com - Lytle, D. A. dan Schock, M. R. (1996). Waktu Stagnasi, Komposisi, PH, dan Efek Orthophosphate pada Pelindian Logam dari Kuningan. Ohio: A.S. Badan Perlindungan Lingkungan.
- Crabwee, T. D.; Pelletier, S. J. dan Pruett, T. L. (2001). Antisepsis bedah Dalam S. S. Block (editor), Disinfeksi, Sterilisasi, dan Pelestarian, hlm. 919-934. Philadelphia: Lippincott Williams & Wilkins.
- Byrne, R. H. et al (2017, 07 Juni). Air laut. Encyclopædia Britannica. Diperoleh pada 17 Oktober 2017, dari britannica.com
- Plutowska B. dan Wardencki, W. (2012). Kromatografi gas - penciuman minuman beralkohol. Dalam J. Piggott (editor), Minuman Beralkohol: Evaluasi Sensori dan Riset Konsumen, hal.101-122. Philadelphia: Woodhead Publishing.
- Apa itu kabut? (2017, 12 Juli). Met Office (Inggris). metoffice.gov.uk
- Helmenstine, A. M ... (2016, 16 Februari). Apa Komposisi Kimia Cuka? Diperoleh pada 17 Oktober 2017, dari thoughtco.com
- Phinney, D. J. dan Halstead, J. H. (2017). Bantuan Gigi: Suatu Pendekatan Komprehensif. Massachusetts: Cengage Learning.
- Britannica, E. (s.f.) Solusi-Kimia Diperoleh dari britannica.com
- Wikipedia. (s.f.). Kelarutan. Diperoleh dari en.wikipedia.org
- Zona kelas (s.f.). Solut. Diperoleh dari frsd.k12.nj.us
- ChemGuide. (s.f.). Solusi dan Kelarutan Jenuh. Diperoleh dari chem.libretexts.org
- Madhusha (s.f.). Perbedaan Antara Solvent dan Solute. Diperoleh dari pediaa.com.


