Garam organik memiliki sifat fisik dan kimia, kegunaan dan contoh
itu garam organik mereka adalah sejumlah besar senyawa ionik dengan karakteristik yang tak terhitung banyaknya. Mereka sebelumnya berasal dari senyawa organik, yang telah mengalami transformasi yang memungkinkannya menjadi pembawa muatan, dan itu juga, identitas kimianya tergantung pada ion yang terkait..
Pada gambar di bawah ini ditampilkan dua formula kimia yang sangat umum untuk garam organik. Yang pertama, R-AX, ditafsirkan sebagai senyawa di mana struktur karbonnya atom, atau kelompok A, membawa muatan positif + atau negatif (-).
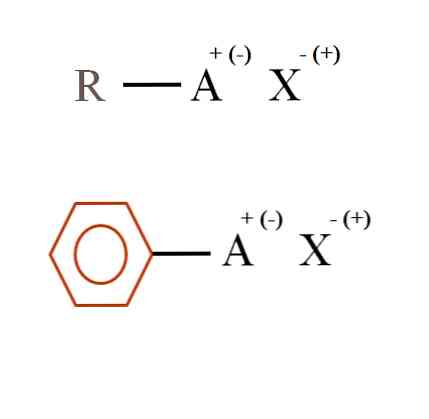
Seperti dapat dilihat, ada ikatan kovalen antara R dan A, R-A, tetapi pada gilirannya, A memiliki muatan formal yang menarik (atau mengusir) ion X. Tanda muatannya akan tergantung pada sifat A dan lingkungan kimia..
Jika A positif, berapa banyak X yang dapat berinteraksi dengannya? Dengan hanya satu, diberikan prinsip electroneutrality (+ 1-1 = 0). Namun, apa identitas X? Anion X bisa menjadi CO32-, membutuhkan dua kation RA+; a halogenide: F-, Cl-, Br-, dll; atau bahkan, senyawa RA lainnya-. Opsi tidak terhitung.
Juga, garam organik dapat memiliki karakter aromatik, diilustrasikan dalam cincin benzena coklat. Garam tembaga benzoat (II), (C6H5COO)2Cu, misalnya, terdiri dari dua cincin aromatik dengan gugus karboksil bermuatan negatif, yang berinteraksi dengan kation Cu.2+.
Indeks
- 1 Sifat fisik dan kimia
- 1.1 Massa molekul tinggi
- 1.2 Amfifilis dan surfaktan
- 1.3 Titik didih atau leleh yang tinggi
- 1.4 Keasaman dan kebasaan
- 2 Penggunaan
- 3 Contoh garam organik
- 3.1 Karboksilat
- 3,2 Lithium diacryluprates
- 3.3 Garam sulfonium
- 3.4 Garam oksonium
- 3.5 Garam amina
- 3,6 Diazonium garam
- 4 Referensi
Sifat fisik dan kimia
Dari gambar dapat dinyatakan bahwa garam organik terdiri dari tiga komponen: organik, R atau Ar (cincin aromatik), atom atau kelompok yang membawa muatan ionik A, dan counterion X.
Sama seperti identitas dan struktur kimia didefinisikan oleh komponen-komponen tersebut, demikian pula sifat-sifatnya bergantung padanya.
Dari fakta ini dapat diringkas sifat umum tertentu yang memenuhi sebagian besar garam ini.
Massa molekul tinggi
Dengan asumsi mono atau anion X anorganik polivalen, garam organik biasanya memiliki massa molekul yang jauh lebih besar daripada garam anorganik. Hal ini terutama disebabkan oleh kerangka karbon, yang ikatan C-C sederhana, dan atom hidrogennya, berkontribusi banyak massa pada senyawa..
Oleh karena itu, mereka bertanggung jawab atas berat molekulnya yang tinggi.
Amfifil dan surfaktan
Garam organik adalah senyawa amfifilik, yaitu strukturnya memiliki ujung hidrofilik dan hidrofobik.
Apa yang ekstrem seperti itu? R atau Ar mewakili ujung hidrofobik, karena atom C dan H mereka tidak memiliki afinitas yang besar untuk molekul air.
A+(-), atom atau kelompok yang membawa muatan, adalah ujung hidrofilik, karena ia berkontribusi terhadap momen dipolar dan berinteraksi dengan air membentuk dipol (RA+ OH2).
Ketika daerah hidrofilik dan hidrofobik terpolarisasi, garam amfifilik menjadi surfaktan, zat yang banyak digunakan untuk pembuatan deterjen dan demulsifier.
Titik didih tinggi atau titik leleh
Seperti garam anorganik, garam organik juga memiliki titik leleh dan titik didih yang tinggi, karena gaya elektrostatik yang mengatur fase cair atau padat.
Namun, memiliki komponen organik R atau Ar, tipe lain dari gaya Van der Waals (gaya London, dipol-dipol, jembatan hidrogen) yang bersaing dalam cara tertentu dengan elektrostatik.
Untuk alasan ini, struktur padat atau cair dari garam organik, pada contoh pertama, lebih kompleks dan bervariasi. Beberapa dari mereka bahkan dapat berperilaku seperti kristal cair.
Keasaman dan kebasaan
Garam organik biasanya merupakan asam atau basa yang lebih kuat daripada garam anorganik. Ini karena A, misalnya dalam garam amina, memiliki muatan positif karena ikatannya dengan hidrogen tambahan: A+-H. Kemudian, dalam kontak dengan pangkalan, sumbangkan proton untuk kembali menjadi senyawa netral:
RA+H + B => RA + HB
H milik A, tetapi ditulis ketika ia ikut campur dalam reaksi netralisasi.
Di sisi lain, RA+ mungkin molekul besar, tidak dapat membentuk padatan dengan jaringan kristal yang cukup stabil dengan anion hidroksil atau hidroksil OH-.
Jika demikian, garam RA+OH- berperilaku seperti basis yang kuat; bahkan sama mendasarnya dengan NaOH atau KOH:
RA+OH- + HCl => RACl + H2O
Perhatikan dalam persamaan kimia bahwa anion Cl- itu menggantikan OH-, membentuk garam RA+Cl-.
Penggunaan
Penggunaan garam organik akan bervariasi sesuai dengan identitas R, Ar, A dan X. Selain itu, aplikasi yang ditakdirkan juga tergantung pada jenis padat atau cair yang mereka bentuk. Beberapa generalisasi dalam hal ini adalah:
-Mereka berfungsi sebagai reagen untuk sintesis senyawa organik lainnya. RAX dapat bertindak sebagai "donor" rantai R untuk ditambahkan ke senyawa lain menggantikan kelompok keluar yang baik.
-Mereka adalah surfaktan, sehingga mereka juga dapat digunakan sebagai pelumas. Garam logam karboksilat digunakan untuk tujuan ini.
-Mereka memungkinkan untuk mensintesis berbagai macam pewarna.
Contoh garam organik
Karboksilat
Asam karboksilat bereaksi dengan hidroksida dalam reaksi netralisasi, sehingga menimbulkan garam karboksilat: RCOO- M.+; dimana M+ Itu bisa berupa kation logam apa saja (Na+, Pb2+, K+, dll) atau kation amonium NH4+.
Asam lemak adalah asam karboksilat alifatik rantai panjang, mereka bisa jenuh dan tidak jenuh. Asam palmitat (CH) termasuk yang jenuh3(CH2)14COOH). Ini berasal garam palmitat, sedangkan asam stearat (CH3(CH2)16COOH membentuk garam stearat. Sabun terbuat dari garam-garam ini.
Dalam kasus asam benzoat, C6H5COOH (di mana C6H5- itu adalah cincin benzena), ketika bereaksi dengan basa membentuk garam benzoat. Di semua karboksilat, kelompok -COO- mewakili A (RAX).
Lithium diacupuprates
Litium diacuprate berguna dalam sintesis organik. Formulanya adalah [R-Cu-R]-Li+, di mana atom tembaga membawa muatan negatif. Di sini, tembaga mewakili atom A dari gambar.
Garam sulfonium
Mereka terbentuk dari reaksi sulfida organik dengan alkil halida:
R2S + R'X => R2R'S+X
Untuk garam-garam ini, atom sulfur membawa muatan formal positif (S+) memiliki tiga ikatan kovalen.
Garam oksonium
Juga, eter (analog teroksigenasi dari sulfida) bereaksi dengan hidrosida untuk membentuk garam oksonium:
ROR '+ HBr <=> RO+HR '+ Br-
Proton asam HBr terikat secara kovalen dengan atom oksigen eter (R2O+-H), memuatnya secara positif.
Garam Amine
Amina dapat berupa primer, sekunder, tersier atau kuaterner, serta garamnya. Semuanya ditandai dengan memiliki atom H yang terhubung ke atom nitrogen.
Jadi, RNH3+X- itu adalah garam amina primer; R2NH2+X-, amina sekunder; R3NH+X-, dari amina tersier; dan R4N+X-, dari amina kuartener (garam amonium kuaterner).
Garam diazonium
Akhirnya, garam diazonium (RN2+X-) atau arildiazonium (ArN)2+X-), merupakan titik awal untuk banyak senyawa organik, terutama pewarna azo.
Referensi
- Francis A. Carey. Kimia Organik (Edisi keenam., Hal. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons TW., Craig B. Fryhle. Kimia Organik. Amina (Edisi ke-10.). Wiley Plus.
- Wikipedia. (2018). Garam (Kimia). Diambil dari: en.wikipedia.org
- Steven A. Hardinger. (2017). Illustrated Glosarium Kimia Organik: garam. Diperoleh dari: chem.ucla.edu
- Chevron Oronite. (2011). Karboksilat. [PDF] Diperoleh dari: oronite.com


