Apa itu solusi jenuh? (dengan contoh)
Satu solusi jenuh adalah larutan kimia yang mengandung konsentrasi maksimum zat terlarut dalam pelarut. Ini dianggap sebagai keadaan keseimbangan dinamis di mana kecepatan di mana pelarut melarutkan zat terlarut dan laju rekristalisasi sama (J., 2014).
Larutan tambahan tidak akan larut dalam larutan jenuh dan akan muncul dalam fase yang berbeda, apakah itu endapan jika padat dalam cairan atau efervesensi jika itu adalah gas dalam cairan (Anne Marie Helmenstine, 2016).
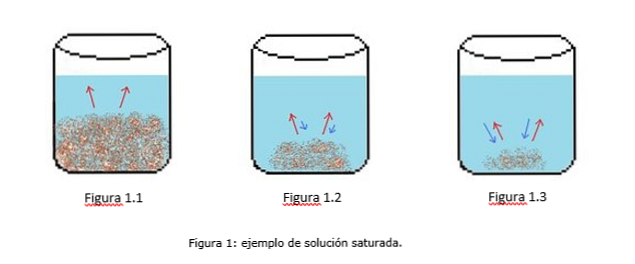
Contoh dari solusi jenuh diilustrasikan pada Gambar 1. Pada Gambar 1.1, 1.2 dan 1.3 ada volume air yang konstan di dalam gelas kimia. Pada Gambar 1.1 mulai proses saturasi, di mana zat terlarut mulai larut, diwakili oleh panah merah.
Pada Gambar 1.2, sebagian besar padatan telah larut, tetapi tidak sepenuhnya karena proses rekristalisasi, diwakili oleh panah biru.
Pada Gambar 1.3, hanya sejumlah kecil zat terlarut yang tetap tidak larut. Dalam hal ini, laju rekristalisasi lebih besar daripada laju disolusi. (tip of saturation, 2014)
Titik konsentrasi maksimum zat terlarut dalam pelarut dikenal sebagai titik jenuh.
Indeks
- 1 Faktor yang mempengaruhi saturasi
- 1.1 Suhu
- 1.2 Tekanan
- 1.3 Komposisi kimia
- 1.4 Faktor mekanis
- 2 Kurva saturasi dan kelarutan
- 3 Contoh solusi jenuh
- 4 Apa itu solusi yang terlalu jenuh?
- 5 Referensi
Faktor yang mempengaruhi saturasi
Jumlah zat terlarut yang dapat larut dalam pelarut akan tergantung pada berbagai faktor, di antaranya yang paling penting adalah:
Suhu
Kelarutan meningkat dengan suhu. Misalnya, Anda dapat melarutkan lebih banyak garam dalam air panas daripada air dingin.
Namun, mungkin ada pengecualian, misalnya, kelarutan gas dalam air berkurang dengan meningkatnya suhu. Dalam hal ini, molekul terlarut menerima energi kinetik ketika dipanaskan, yang memfasilitasi pelarian mereka.
Tekanan
Peningkatan tekanan dapat memaksa pembubaran zat terlarut. Ini biasanya digunakan untuk melarutkan gas dalam cairan.
Komposisi kimia
Sifat zat terlarut dan pelarut serta keberadaan senyawa kimia lainnya dalam larutan mempengaruhi kelarutan. Misalnya, Anda bisa melarutkan gula dalam jumlah yang lebih banyak daripada garam dalam air. Dalam hal ini dikatakan bahwa gula lebih mudah larut.
Etanol dalam air sepenuhnya larut satu sama lain. Dalam kasus khusus ini, pelarut akan menjadi senyawa yang jumlahnya lebih banyak.
Faktor mekanis
Berbeda dengan laju disolusi, yang terutama tergantung pada suhu, laju rekristalisasi tergantung pada konsentrasi zat terlarut pada permukaan kisi kristalin, yang disukai ketika larutan tidak bergerak.
Oleh karena itu, agitasi solusi menghindari akumulasi ini, memaksimalkan pembubaran (ujung jenuh, 2014).
Kurva saturasi dan kelarutan
Kurva kelarutan adalah basis data grafis di mana jumlah zat terlarut yang larut dalam jumlah pelarut dibandingkan, pada suhu tertentu.
Kurva kelarutan umumnya diplot untuk jumlah zat terlarut, baik padat atau gas, dalam 100 gram air (Brian, 2014).
Gambar 2 mengilustrasikan kurva saturasi untuk beberapa zat terlarut dalam air.

Dalam poros koordinat Anda memiliki suhu dalam derajat celcius, dan dalam sumbu absis Anda memiliki konsentrasi zat terlarut yang dinyatakan dalam gram zat terlarut per 100 gram air.
Kurva menunjukkan titik jenuh pada suhu tertentu. Area di bawah kurva menunjukkan bahwa Anda memiliki solusi tidak jenuh dan karenanya Anda dapat menambahkan lebih banyak zat terlarut.
Area di atas kurva memiliki solusi jenuh. (Kurva Kelarutan, s.f.)
Ambil contoh natrium klorida (NaCl), pada 25 derajat celcius, Anda dapat melarutkan sekitar 35 gram NaCl dalam 100 gram air untuk mendapatkan larutan jenuh. (Universitas Cambrige, s.f.)
Contoh solusi jenuh
Solusi jenuh dapat ditemukan setiap hari, tidak perlu berada di laboratorium kimia. Pelarut tidak harus berupa air. Di bawah ini adalah contoh sehari-hari dari solusi jenuh:
-Soda dan minuman ringan pada umumnya adalah larutan jenuh dengan karbon dioksida dalam air. Itulah sebabnya, ketika tekanan dilepaskan, gelembung karbon dioksida terbentuk.
-Tanah tanah jenuh dengan nitrogen.
-Anda bisa menambahkan gula atau garam ke dalam cuka untuk membentuk larutan jenuh.
-Tambahkan bubuk cokelat ke dalam susu sampai tidak larut, membentuk larutan jenuh.
-Susu bisa jenuh dengan tepung sedemikian rupa sehingga tidak ada lagi tepung yang bisa ditambahkan ke susu.
-Mentega cair bisa jenuh dengan garam, saat garam tidak lagi larut.
Apa itu solusi jenuh?
Definisi larutan jenuh adalah larutan yang mengandung lebih banyak zat terlarut daripada yang biasanya akan larut dalam pelarut. Ini biasanya dilakukan dengan meningkatkan suhu larutan.
Sedikit perubahan larutan atau pengenalan "benih" atau kristal kecil zat terlarut akan memaksa kristalisasi zat terlarut berlebih. Jika tidak ada titik nukleasi untuk pembentukan kristal, zat terlarut berlebih dapat tetap dalam larutan.
Bentuk lain dari jenuh dapat terjadi ketika larutan jenuh didinginkan dengan hati-hati. Perubahan kondisi ini berarti bahwa konsentrasi sebenarnya lebih besar dari titik jenuh, solusinya telah terlalu jenuh.
Ini dapat digunakan dalam proses rekristalisasi untuk memurnikan bahan kimia: ia larut ke titik jenuh dalam pelarut panas, kemudian saat pelarut mendingin dan kelarutan berkurang, kelebihan endapan zat terlarut.
Pengotor, yang hadir dalam konsentrasi yang jauh lebih rendah, tidak menjenuhkan pelarut dan dengan demikian tetap larut dalam cairan.
Referensi
- Anne Marie Helmenstine, P. (2016, 7 Juli). Definisi dan Contoh Solusi Jenuh. Diperoleh dari about: about.com
- Universitas Cambrige. (s.f.). Kurva kelarutan. Diperoleh dari dynamicscience.com: dynamicscience.com.au.
- Contoh Solusi Jenuh. (s.f.). Diperoleh dari yourdcitionary: example.yourdictionary.com.
- , S. (2014, 4 Juni). Solusi Jenuh dan Jenuh. Diperoleh dari socratic.org: socratic.org.
- James, N. (s.f.). Solusi Jenuh: Definisi & Contoh. Diperoleh dari study.com: study.com.
- , B. (2014, 14 Oktober). Solusi Jenuh dan Jenuh. Diperoleh dari socratic.org: socratic.org.
- Kurva Kelarutan. (s.f.). Diperoleh dari KentChemistry: kentchemistry.com.
- Kiat saturasi. (2014, 26 Juni). Diperoleh dari libretex kimia: chem.libretexts.org.


