Sodium Dichromate Properties, Produksi, Bahaya dan Penggunaan
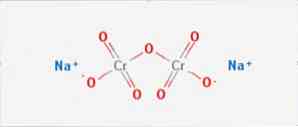
itu natrium dikromat adalah senyawa anorganik rumus Na2Cr2O7. Ini adalah salah satu dari banyak senyawa kromium heksavalen (Cr VI). Strukturnya diilustrasikan pada Gambar 1, meskipun biasanya garam ditangani dalam bentuk dihidrat yang rumusnya adalah Na2Cr2O7 · H2O.
Ini memiliki dua ikatan ion antara molekul natrium dan oksigen yang bermuatan negatif. Bijih kromium diekstraksi dari natrium dikromat. Jutaan kilogram natrium dikromat diproduksi setiap tahun.
Cina adalah produsen natrium dikromat, namun pabrik kimia Cina memiliki produksi yang relatif rendah, masing-masing kurang dari 50.000 ton per tahun, dibandingkan dengan pabrik Kazakhstan yang memproduksi lebih dari 100.000 ton per tahun.
Pabrik di Rusia, Amerika Serikat dan Inggris memiliki produksi antara antara 50.000 dan 100.000 ton per tahun (Kogel, 2006).
Dalam hal reaktivitas dan penampilan, natrium dikromat memiliki sifat yang mirip dengan kalium dikromat, namun, garam natrium lebih larut dalam air dan memiliki berat setara kurang dari garam kalium.
Sodium dichromate menghasilkan uap chromium beracun saat dipanaskan. Ini adalah agen pengoksidasi yang kuat dan sangat korosif.
Senyawa ini dapat ditemukan dalam sumber air minum yang terkontaminasi oleh berbagai proses industri seperti teknik galvanisasi atau pelapisan kulit, penyamakan kulit dan pembuatan tekstil.
Indeks
- 1 Sifat fisik dan kimia
- 2 metode produksi
- 3 Reaktivitas dan bahaya
- 4 Penggunaan dan aplikasi
- 5 Biokimia
- 6 Referensi
Sifat fisik dan kimia
Natrium dikromat dibuat dari kristal dengan struktur monoklinik oranye kemerahan dalam bentuk anhidrat dan tidak berbau. Berat molekulnya adalah 261,97 g / mol dalam bentuk anhidrat dan 298,00 g / mol dalam bentuk dihidrasi.
Ia memiliki titik leleh 356,7 derajat Celcius, titik didih 400 derajat Celcius di mana ia terurai. Ini memiliki kepadatan 2,52 g / ml.

Gambar 2 menunjukkan penampilan natrium dikromat. Kelarutannya dalam air adalah 187 g per 100 gram pada 25 derajat Celcius dan kelarutannya dalam etanol adalah 513,2 gram per liter pada 19,4 derajat Celcius (Pusat Nasional untuk Informasi Bioteknologi, s.f.).
Ini dianggap senyawa stabil jika disimpan dalam kondisi yang disarankan dan tidak mudah terbakar. Karena merupakan agen pengoksidasi yang kuat, ia bersifat korosif, dan dalam larutan itu asam memiliki kemampuan untuk menurunkan pH hingga 4 dalam larutan 1% b / v.
Metode produksi
Natrium kromat dapat dikonversi menjadi dikromat dengan proses kontinu yang memperlakukan dengan asam sulfat, karbon dioksida atau kombinasi keduanya..
Penguapan cairan natrium dikromat menyebabkan pengendapan natrium sulfat dan / atau natrium bikarbonat, dan senyawa-senyawa ini dihilangkan sebelum kristalisasi akhir natrium dikromat..
Sodium dichromate dapat dilakukan dalam proses tiga langkah:
- Memanggang basa dengan kondisi oksidasi kromit
- Pencucian. Ekstraksi zat terlarut dari campuran dengan aksi pelarut cair
- Konversi natrium monokromat dalam natrium dikromat melalui suatu asam.
Natrium dikromat dikhidrat dapat dibuat dengan melelehkan natrium dihidrat dihidrat, mengkristal larutan dikromat berair di atas 86 derajat C, atau mengeringkan larutan natrium dikromat dalam pengering semprot.
Larutan natrium dikromat pada 69 dan 70% b / v digunakan sebagai metode pengiriman yang nyaman dan hemat biaya, menghindari kebutuhan untuk penanganan manual atau pembubaran kristal.
Reaktivitas dan bahaya
Ini adalah agen pengoksidasi yang kuat. Tidak cocok dengan asam kuat. Kontak dengan bahan yang mudah terbakar dapat menyebabkan kebakaran. Uap beracun kromium oksida dapat terbentuk di hadapan panas atau api.
"Campuran asam kromat" yang dikenal dari dikromat dan asam sulfat dengan residu organik menimbulkan reaksi eksotermik yang keras. Campuran ini dalam kombinasi dengan residu aseton juga menyebabkan reaksi yang keras.
Kombinasi dikromat dan asam sulfat dengan alkohol, etanol, dan 2-propanol, menimbulkan reaksi eksotermik yang keras. Karena terjadinya banyak insiden yang melibatkan pencampuran asam dikromat-sulfat dengan bahan organik teroksidasi, mungkin lebih baik untuk menghindari interaksi tersebut.
Kombinasi dikromat dengan hidrazin bersifat eksplosif, reaksi dikromat dapat diharapkan kuat dengan amina pada umumnya. Penambahan garam dikromatat yang didehidrasi menjadi anhidrida asetat menghasilkan reaksi eksotermik yang akhirnya meledak.
Boron, silikon dan dikromat membentuk campuran piroteknik. Campuran asam asetat, 2-metil-2-pentenal dan dikromat menyebabkan reaksi yang merajalela (Lembar Data Kimia Sodium Dichromate., 2016).
Menghirup debu atau kabut menyebabkan iritasi pernapasan yang terkadang menyerupai asma. Perforasi septum dapat terjadi. Itu dianggap racun.
Tertelan menyebabkan muntah, diare, dan, yang sangat luar biasa, komplikasi pada lambung dan ginjal. Kontak dengan mata atau kulit menyebabkan iritasi lokal. Paparan berulang pada kulit menyebabkan dermatitis.
Sodium dichromate adalah karsinogen pada manusia. Ada bukti bahwa senyawa kromium heksavalen atau Cr (VI) dapat menyebabkan kanker paru-paru pada manusia. Telah ditunjukkan bahwa natrium dikromat menyebabkan kanker paru-paru pada hewan.
Meskipun natrium dikromat belum diidentifikasi sebagai senyawa teratogenik atau risiko reproduksi, diketahui bahwa senyawa kromium heksavalen atau Cr (VI) bersifat teratogenik dan menyebabkan kerusakan reproduksi seperti mengurangi kesuburan dan mengganggu siklus menstruasi..
Sodium dichromate dapat menyebabkan kerusakan hati dan ginjal sehingga harus dikelola dengan sangat hati-hati (New Jersey Department of Health, 2009).
Jika tertelan, korban harus minum air atau susu; jangan dimuntahkan. Dalam kasus kontak dengan kulit atau mata itu harus diperlakukan sebagai luka bakar asam; Bilas mata Anda dengan air setidaknya selama 15 menit.
Lesi eksternal dapat digosok dengan larutan natrium tiosulfat 2%. Dalam semua kasus, seorang dokter harus dikonsultasikan.
Penggunaan dan aplikasi
Terlepas dari pentingnya dalam pembuatan bahan kimia kromium lainnya, natrium dikromat juga memiliki banyak kegunaan langsung sebagai bahan dalam produksi:
- Lapisan logam: membantu ketahanan korosi dan membersihkan permukaan logam, juga mendukung daya rekat cat.
- Produk organik: digunakan sebagai agen pengoksidasi dalam pembuatan produk seperti vitamin K dan lilin.
- Pigmen: digunakan dalam pembuatan pigmen kromat anorganik di mana ia menghasilkan berbagai warna yang stabil terhadap cahaya. Beberapa tingkatan kromat juga digunakan sebagai penghambat korosi pada lapisan bawah dan primer.
- Keramik: digunakan dalam persiapan gelas berwarna dan glasir keramik.
- Tekstil: digunakan sebagai mordan untuk pewarna asam untuk meningkatkan sifat pewarnaannya yang cepat.
- Produksi kromium sulfat.
(Sodium dichromate, The building block untuk hampir semua senyawa kromium lainnya., 2010-2012)
Sodium dichromate Dihydrate, penggunaannya sangat ideal dalam berbagai kondisi termasuk aplikasi suhu tinggi, seperti keramik dan kaca berwarna.
Chromic oxide, menjadi lebih keras daripada oksida logam lainnya, seperti titanium atau besi, sangat ideal untuk lingkungan di mana suhu dan kondisi proses agresif.
Zat ini terutama digunakan untuk menghasilkan senyawa kromium lain, tetapi juga digunakan dalam lumpur bentonit yang digunakan dalam produksi minyak, pengawet kayu, dalam produksi bahan kimia organik dan sebagai penghambat korosi..
Ketika dicampur dengan aluminium dan kalium dikromat, menggunakan proses alumino-termal, oksida krom menghasilkan kromium logam kemurnian tinggi. Ini adalah unsur penting dalam produksi superalloy kinerja tinggi yang digunakan dalam industri dirgantara.
Dalam sintesis organik, natrium dikromat digunakan sebagai zat pengoksidasi dalam reaksi reduksi oksida dengan adanya asam sulfat.
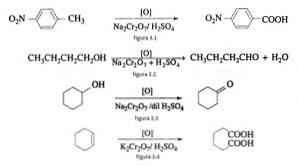
Misalnya oksidasi p-nitrotoluene membentuk asam p-nitrobenzoat, dalam oksidasi n-butanol menjadi n-butaldehida, dalam pembentukan sikloheksanon dari sikloheksanol dan pembentukan asam adipat seperti yang diilustrasikan dalam Gambar 3.1. , 3,2, 3,3 dan 3,4 masing-masing (VK Ahluwalia, 2004).
Biokimia
Berangsur-angsur intratrakeal natrium dikromat (CrVI) dan kromium asetat hidroksida (CrIII) pada tikus jantan menghasilkan peningkatan konsentrasi kromium dalam seluruh darah, plasma dan urin hingga 72 jam setelah paparan; Konsentrasi maksimum dicapai pada 6 jam setelah paparan.
Rasio antara konsentrasi krom darah keseluruhan dan plasma kromium berbeda secara signifikan untuk perawatan Cr (VI) dan Cr (III). Oleh karena itu, analisis kromium dalam darah dan kromium dalam plasma harus digunakan untuk evaluasi paparan kromium.
Chromium juga terdeteksi pada limfosit perifer. Cr (VI), tetapi tidak Cr (III) terakumulasi secara signifikan dalam limfosit setelah perawatan. Sel-sel ini memiliki potensi untuk digunakan sebagai biomarker dalam evaluasi paparan senyawa kromium (Hooth, 2008).
Referensi
- Lembar Data Kimia Natrium Dikromat. (2016). Diperoleh dari cameo bahan kimia: cameochemicals.noaa.
- Hooth, M. J. (2008). Laporan Teknis Studi Toksikologi dan Karsinogenesis Sodium Dichromate Dihydrated. Institut Kesehatan Nasional AS.
- Kogel, J. E. (2006). Mineral Industri & Batuan: Komoditas, Pasar, dan Penggunaan edisi ketujuh. littleton colorado: masyarakat pertambangan, metalurgi dan eksplorasi inc.
- Pusat Nasional untuk Informasi Bioteknologi. (s.f.). Basis Data Gabungan PubChem; CID = 25408. Diperoleh dari pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Departemen Kesehatan New Jersey. (2009, November). lembar fakta zat berbahaya natrium dikromat. Diperoleh dari nj.gov: nj.gov.
- Natrium dikromat. Blok bangunan untuk hampir semua senyawa kromium lainnya. (2010-2012). Diperoleh dari elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Kimia Organik Praktis Komprehensif: Persiapan Dan Analisis Kuantitatif. Delhi: Pers universitas (India).


