Metode Pengurangan Gula Untuk Penentuan, Pentingnya
itu mengurangi gula mereka adalah biomolekul yang berfungsi sebagai agen pereduksi; yaitu, mereka dapat menyumbangkan elektron ke molekul lain yang dengannya mereka bereaksi. Dengan kata lain, gula pereduksi adalah karbohidrat yang mengandung gugus karbonil (C = O) dalam strukturnya.
Kelompok karbonil ini dibentuk oleh atom karbon yang terikat pada atom oksigen melalui ikatan rangkap. Kelompok ini dapat ditemukan dalam posisi berbeda dalam molekul gula, menghasilkan gugus fungsi lain seperti aldehida dan keton.
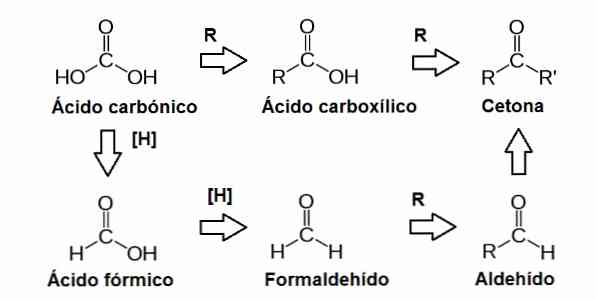
Aldehida dan keton ditemukan dalam molekul gula sederhana atau monosakarida. Gula ini diklasifikasikan dalam ketosis jika mereka memiliki gugus karbonil di dalam molekul (keton), atau dalam aldosis jika mereka mengandungnya dalam posisi terminal (aldehida).
Aldehida adalah kelompok fungsional yang dapat melakukan reaksi reduksi oksidasi, yang melibatkan pergerakan elektron antar molekul. Oksidasi terjadi ketika sebuah molekul kehilangan satu atau lebih elektron, dan reduksi ketika sebuah molekul memperoleh satu atau lebih elektron.
Dari jenis karbohidrat yang ada, monosakarida semuanya merupakan gula pereduksi. Misalnya, glukosa, galaktosa, dan fruktosa berfungsi sebagai agen pereduksi.
Dalam beberapa kasus, monosakarida adalah bagian dari molekul yang lebih besar seperti disakarida dan polisakarida. Untuk alasan ini, beberapa disakarida - seperti maltosa - juga berperilaku seperti mengurangi gula.
Indeks
- 1 Metode untuk menentukan gula pereduksi
- 1.1 Tes Benediktus
- 1.2 Pereaksi Fehling
- 1.3 Pereaksi tol
- 2 Pentingnya
- 2.1 Pentingnya dalam pengobatan
- 2.2 Reaksi Maillard
- 2.3 Kualitas makanan
- 3 Perbedaan antara gula pereduksi dan gula tidak pereduksi
- 4 Referensi
Metode untuk menentukan gula pereduksi
Tes Benedict
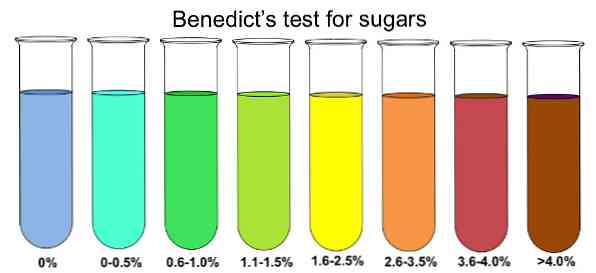
Untuk menentukan keberadaan gula pereduksi dalam sampel, gula larut dalam air mendidih. Selanjutnya, sejumlah kecil reagen Benedict ditambahkan dan solusinya dibiarkan mencapai suhu kamar. Dalam 10 menit berikutnya solusinya akan mulai berubah warna.
Jika warnanya berubah menjadi biru, maka tidak ada gula reduksi, terutama glukosa. Jika ada sejumlah besar glukosa hadir dalam sampel untuk dianalisis, maka perubahan warna akan berlanjut menjadi hijau, kuning, oranye, merah dan akhirnya coklat.
Pereaksi Benedict adalah campuran beberapa senyawa: itu termasuk anhidrat natrium karbonat, natrium sitrat dan tembaga (II) sulfat pentahidrat. Setelah ditambahkan ke larutan dengan sampel, kemungkinan reaksi reduksi oksida akan dimulai.
Jika ada gula pereduksi, ini akan mengurangi tembaga sulfat (warna biru) dari larutan Benedict menjadi tembaga sulfida (warna kemerahan), yang terlihat seperti endapan dan bertanggung jawab atas perubahan warna.
Gula non-pereduksi tidak dapat melakukan ini. Tes khusus ini hanya memberikan pemahaman kualitatif tentang keberadaan gula pereduksi; yaitu, ini menunjukkan apakah ada gula pereduksi dalam sampel atau tidak.
Reagen Fehling
Mirip dengan tes Benedict, tes Fehling mensyaratkan bahwa sampel harus sepenuhnya dilarutkan dalam larutan; Ini dilakukan di hadapan panas untuk memastikan bahwa itu larut sepenuhnya. Setelah ini, solusi Fehling ditambahkan sambil terus diaduk.
Jika ada gula pereduksi, solusinya akan mulai berubah warna sebagai oksida atau bentuk endapan merah. Jika tidak ada gula pereduksi yang ada, solusinya akan tetap biru atau hijau. Solusi Fehling juga disiapkan dari dua solusi lain (A dan B).
Larutan A mengandung tembaga (II) sulfat pentahidrat yang dilarutkan dalam air, dan larutan B mengandung kalium natrium tartrat tetrahidrat (garam Rochelle) dan natrium hidroksida dalam air. Dua solusi dicampur dalam bagian yang sama untuk membuat solusi tes akhir.
Tes ini digunakan untuk menentukan monosakarida, khususnya aldosis dan ketosis. Ini terdeteksi ketika aldehida dioksidasi menjadi asam dan membentuk oksida tembaga.
Setelah kontak dengan gugus aldehida direduksi menjadi ion tembaga, yang membentuk endapan merah dan menunjukkan adanya gula pereduksi. Jika tidak ada gula pereduksi dalam sampel, larutan akan tetap berwarna biru, menunjukkan hasil negatif untuk tes ini..
Pereaksi tolol
Tes Tollens, juga dikenal sebagai tes cermin perak, adalah tes laboratorium kualitatif yang digunakan untuk membedakan antara aldehida dan keton. Ini mengeksploitasi fakta bahwa aldehida mudah teroksidasi, sedangkan keton tidak.
Dalam tes Tollens, campuran yang dikenal sebagai reagen Tollens digunakan, yang merupakan larutan dasar yang mengandung ion perak yang dikoordinasikan dengan amonia..
Reagen ini tidak tersedia secara komersial karena masa manfaatnya yang singkat, jadi harus disiapkan di laboratorium ketika akan digunakan.
Persiapan reagen melibatkan dua langkah:
Langkah 1
Nitrat perak berair dicampur dengan natrium hidroksida berair.
Langkah 2
Amonia berair ditambahkan setetes demi setetes sampai endapan perak oksida larut sepenuhnya.
Reagen Tollens mengoksidasi aldehida yang ada dalam gula pereduksi yang sesuai. Reaksi yang sama melibatkan pengurangan ion perak dari reagen Tollens, yang mengubahnya menjadi perak logam. Jika tes dilakukan dalam tabung reaksi yang bersih, endapan perak terbentuk.
Dengan demikian, hasil positif dengan pereaksi Tollens ditentukan dengan mengamati "cermin perak" di dalam tabung reaksi; efek cermin ini adalah karakteristik dari reaksi ini.
Signifikansi
Menentukan keberadaan gula pereduksi dalam sampel yang berbeda adalah penting dalam beberapa aspek yang meliputi obat-obatan dan keahlian memasak.
Pentingnya dalam pengobatan
Tes skrining untuk mengurangi gula telah digunakan selama bertahun-tahun untuk mendiagnosis pasien dengan diabetes. Ini dapat dilakukan karena penyakit ini ditandai oleh peningkatan kadar glukosa darah, di mana penentuan ini dapat dilakukan dengan metode oksidasi ini..
Dengan mengukur jumlah zat pengoksidasi dikurangi dengan glukosa, adalah mungkin untuk menentukan konsentrasi glukosa dalam sampel darah atau urin.
Hal ini memungkinkan pasien untuk menunjukkan jumlah insulin yang tepat yang harus disuntikkan sehingga kadar glukosa darah kembali dalam kisaran normal.
Reaksi Maillard
Reaksi Maillard mencakup serangkaian reaksi kompleks yang terjadi ketika memasak beberapa makanan. Ketika suhu makanan meningkat, gugus karbonil dari gula pereduksi bereaksi dengan gugus amino dari asam amino.
Reaksi memasak ini menghasilkan beragam produk dan, meskipun banyak yang bermanfaat bagi kesehatan, yang lain beracun dan bahkan bersifat karsinogenik. Untuk alasan ini, penting untuk mengetahui sifat kimia gula pereduksi yang termasuk dalam makanan normal.
Ketika memasak makanan yang kaya akan kentang-seperti pati - pada suhu yang sangat tinggi (lebih dari 120 ° C) terjadi reaksi Maillard.
Reaksi ini terjadi antara asam amino asparagin dan gula pereduksi, menghasilkan molekul akrilamida, yang merupakan neurotoksin dan kemungkinan karsinogen..
Kualitas makanan
Kualitas makanan tertentu dapat dipantau menggunakan metode deteksi gula pereduksi. Misalnya: untuk anggur, jus, dan tebu, tingkat gula pereduksi ditentukan sebagai indikasi kualitas produk..
Untuk penentuan gula pereduksi dalam makanan, pereaksi Fehling dengan metilen biru biasanya digunakan sebagai indikator reduksi oksida. Modifikasi ini umumnya dikenal sebagai metode Lane-Eynon.
Perbedaan antara gula pereduksi dan gula tidak pereduksi
Perbedaan antara gula pereduksi dan tidak pereduksi terletak pada struktur molekulnya. Karbohidrat yang mengurangi molekul lain melakukannya dengan menyumbangkan elektron dari kelompok aldehida atau keton gratis mereka.
Oleh karena itu, gula yang tidak mereduksi tidak memiliki aldehida atau keton bebas dalam strukturnya. Akibatnya, mereka memberikan hasil negatif dalam tes deteksi gula pereduksi, seperti pada uji Fehling atau Benedict.
Gula pereduksi terdiri dari semua monosakarida dan beberapa disakarida, sedangkan gula yang tidak mereduksi termasuk beberapa disakarida dan semua polisakarida.
Referensi
- Benedict, R. (1907). DETEKSI DAN ESTIMASI PENGURANGAN GULA. Jurnal Kimia Biologis, 3, 101-117.
- Berg, J., Tymoczko, J., Gatto, G. & Strayer, L. (2015). Biokimia (Edisi ke-8). W. H. Freeman dan Perusahaan.
- Chitvoranund, N., Jiemsirilers, S., & Kashima, D. P. (2013). Efek Perlakuan Permukaan pada Adhesi Film Perak pada substrat kaca yang dibuat dengan Pelapisan tanpa listrik. Jurnal Masyarakat Keramik Australia, 49(1), 62-69.
- Hildreth, A., Brown, G. (1942). Modifikasi metode Lane-Eynon untuk penentuan gula. Jurnal Asosiasi Ahli Kimia Analitik Resmi 25 (3): 775-778.
- Jiang, Z., Wang, L., Wu, W., & Wang, Y. (2013). Kegiatan biologis dan sifat fisikokimia produk reaksi Maillard dalam sistem model peptida pasein gula-bovine. Kimia Makanan, 141(4), 3837-3845.
- Nelson, D., Cox, M. & Lehninger, A. (2013). Prinsip Lehninger Biokimia (6th). W.H. Freeman dan Perusahaan.
- Pedreschi, F., Mariotti, M.S., & Granby, K. (2014). Masalah saat ini dalam dietil akrilamida: Pembentukan, mitigasi dan penilaian risiko. Jurnal Ilmu Pangan dan Pertanian, 94(1), 9-20.
- Rajakylä, E., & Paloposki, M. (1983). Penentuan gula (dan betaine) dalam molase dengan kromatografi cair kinerja tinggi. Jurnal Kromatografi, 282, 595-602.
- Timbangan, F. (1915). PENENTUAN PENGURANGAN GULA. Jurnal Kimia Ciologis, 23, 81-87.
- Voet, D., Voet, J. & Pratt, C. (2016). Dasar-dasar Biokimia: Kehidupan di Tingkat Molekul(Edisi ke-5). Wiley.


