Sodium Oxide (Na2O) Formula, Properties, Risiko
itu natrium oksida adalah senyawa anorganik dari rumus Na2O. Seperti semua oksida logam alkali, ia memiliki struktur kristal yang mirip dengan antifluorit (mirip dengan fluorit, CaF2, tetapi dengan kation dan anion terbalik) yang sesuai dengan wajah berpusat kubik. (Sodium: disodium oxide, 1993-2016).
Dapat dikatakan bahwa natrium oksida adalah anhidrida natrium hidroksida, karena bereaksi dengan air untuk membentuk dua mol senyawa ini dengan cara berikut:
Na2O + H2O → 2NaOH
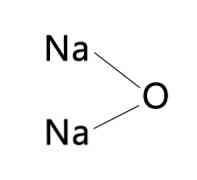
Secara umum, nama KNaO dapat ditemukan, mengacu pada natrium oksida atau kalium oksida. Ini karena kedua oksida memiliki sifat yang sama dalam hal warna dan kecepatan ekspansi dan kontraksi.
Sumber natrium oksida yang sering tidak larut termasuk jejak kalium oksida, misalnya dalam feldspars (gambar 2), yang merupakan sumber utama natrium dalam enamel tertentu (Britt, 2007).

Indeks
- 1 Sifat fisik dan kimia
- 2 Reaktivitas dan bahaya
- 3 Penggunaan
- 4 Referensi
Sifat fisik dan kimia
Sodium oksida adalah padatan kristal putih (gambar 3). Ini memiliki berat molekul 61,98 g / mol, memiliki kepadatan 2,27 g / ml dan titik leleh 1275 ° C.
Senyawa ini memiliki titik didih 1950 ° C di mana ia mulai terurai menjadi natrium dan natrium logam peroksida, namun, sifat yang menarik adalah bahwa natrium oksida mulai menyublim pada 1100 ° C (Pusat Nasional untuk Informasi Bioteknologi, SF ).

Bereaksi hebat dengan air dan alkohol untuk membentuk natrium hidroksida. Sodium oksida, Na2Atau, ia menyerap hidrogen secara terbalik (H2), untuk membentuk natrium hidrida (NaH) dan natrium hidroksida (NaOH), yang berpotensi untuk menemukan aplikasinya pada penyimpanan hidrogen yang dapat dibalik.
Reaktivitas dan bahaya
Sodium oksida adalah senyawa stabil yang tidak mudah terbakar, tetapi dapat bereaksi dengan asam dan air. Itu juga bisa meningkatkan pembakaran zat lain. Itu diklasifikasikan sebagai korosif dan dapat membakar kulit dan mata (Royal Society of Chemistry, 2015).
Larutan dalam air adalah basa kuat, karena bereaksi keras dengan asam bersifat korosif. Ketika bereaksi keras dengan air, natrium hidroksida diproduksi, menyerang banyak logam di hadapan air.
Zat ini juga korosif terhadap saluran pernapasan dan tertelan. Inhalasi aerosol dapat menyebabkan edema paru (Institut Nasional untuk Keselamatan dan Kesehatan Kerja, 2014).
Jika terhirup, orang yang terkena harus dipindahkan ke tempat yang dingin. Jika korban tidak bernafas, pernapasan buatan harus diberikan. Kemudian pergi atau temui dokter sesegera mungkin.
Jika kena kulit, pakaian dan sepatu yang terkontaminasi harus segera dilepas dan dicuci dengan banyak air.
Jika terkena mata, bilas dengan banyak air selama minimal 15 menit dan berkonsultasilah dengan dokter. Jika tertelan, jangan berpikir untuk menyebabkan muntah, tetapi bilas mulut Anda dengan air dan konsultasikan dengan dokter.
Gejala dan efek yang paling penting dapat berupa: kejang, pembengkakan dan edema pada laring dan bronkus, pneumonitis, edema paru, sensasi terbakar, batuk, mengi, radang tenggorokan dan kesulitan bernafas (Sodium oxide (Na2O) (cas 1313-) 59-3) MSDS, 2010-2017).
Gejala edema paru sering tidak bermanifestasi sampai setelah beberapa jam dan diperburuk oleh aktivitas fisik. Istirahat dan observasi medis sangat penting.
Sodium oksida harus disimpan di tempat yang kering dan dipisahkan dari asam kuat. Karena senyawa bereaksi keras dengan air, jika terjadi kebakaran, alat pemadam atau penyiram berbasis air tidak boleh digunakan. Disarankan untuk menggunakan bubuk kering atau pasir.
Penggunaan
Penggunaan utama natrium oksida adalah dalam pembuatan gelas. Digunakan dalam keramik dan gelas, meskipun tidak dalam bentuk mentah. Sodium oksida umumnya membentuk sekitar 15% dari komposisi kimia gelas.
Ini mengurangi suhu di mana silikon dioksida meleleh (komposisi kaca di 70%), sehingga lebih murah dan lebih efisien untuk menghasilkan kaca, karena memerlukan pengeluaran energi yang lebih rendah pada bagian dari produsen (George Sumner, sf ).
Gelas natrium-kapur adalah bentuk paling umum dari gelas yang diproduksi, terdiri dari sekitar 70% silika (silikon dioksida), 15% soda (natrium oksida) dan 9% kapur (kalsium oksida), dengan lebih banyak lagi kecil dari senyawa lain.
Natrium oksida berfungsi sebagai fluks untuk menurunkan suhu di mana silika meleleh, dan kapur bertindak sebagai penstabil untuk silika. Sodium-lime glass murah, stabil secara kimiawi, cukup keras, dan sangat bisa digunakan, karena mampu dilunakkan beberapa kali jika perlu.
Kualitas ini membuatnya cocok untuk pembuatan berbagai produk kaca, termasuk bola lampu, gelas, botol dan benda seni.
Di sisi lain, natrium oksida dan silika mengandung kristal air, juga disebut natrium silikat atau gelas air, yang membentuk padatan vitreous dengan sifat yang sangat berguna yaitu larut dalam air.
Gelas air dijual dalam bentuk benjolan padat atau bubuk, atau sebagai cairan bening dan manis. Ini digunakan sebagai sumber natrium yang mudah digunakan untuk banyak produk industri seperti: produsen deterjen cucian, sebagai pengikat dan perekat, sebagai flokulan di pabrik pengolahan air, dan dalam banyak aplikasi lain (Enciclopaedia britannica, 2017).
Senyawa oksida tidak menghasilkan listrik. Namun, oksida terstruktur tertentu dari perovskite adalah konduktor elektronik untuk aplikasi dalam katoda sel bahan bakar oksida padat dan sistem pembangkit oksigen (American Elements, 1998-2017).
Referensi
- Institut Nasional untuk Keselamatan dan Kesehatan Kerja. (2014, 1 Juli). CDC SODIUM OXIDE. Dipulihkan dari cdc.
- Elemen Amerika. (1998-2017). Sodium Oksida. Dipulihkan dari americanelements.com.
- Britt, J. (2007). Panduan Lengkap untuk Glaze Api Tinggi. New York: Lark Books.
- Encyclopaedia britannica. (2017). Senyawa kimia natrium oksida. Dipulihkan dari britannica.com.
- George Sumner, D. J. (s.f.) Apa kegunaan dari natrium oksida? Dipulihkan dari quora.com.
- Pusat Nasional untuk Informasi Bioteknologi. (S.F.). Basis Data Gabungan PubChem; CID = 73971. Diperoleh dari pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Sodium oksida. Diperoleh dari chemspider.com.
- Ruitao Wang, T. K. (2006). Reaksi hidrogen dengan natrium oksida: Sistem hidrogenasi / dehidrogenasi yang dapat dibalik. Jurnal Sumber Daya, Volume 155, Edisi 2, 167-171. sciencedirect.com.
- Sodium oksida (Na2O) (cas 1313-59-3) MSDS. (2010-2017). Diperoleh dari guidechem: guidechem.com.
- Sodium: disodium oxide. (1993-2016). Diperoleh dari elemen web: webelements.com.


