Teori Dasar-Dasar Elektron, Sifat dan Kerugiannya
itu teori elektron dari elektron Ini adalah hipotesis yang menjelaskan fenomena kimia luar biasa yang terjadi pada ikatan logam antara elemen dengan elektronegativitas rendah. Ini adalah tentang pembagian elektron antara atom yang berbeda yang dihubungkan oleh ikatan logam.
Kepadatan elektronik antara tautan-tautan ini sedemikian rupa sehingga elektron-elektron terdelokalisasi dan membentuk "laut" di mana mereka bergerak bebas. Ia juga dapat diekspresikan oleh mekanika kuantum: beberapa elektron (biasanya satu hingga tujuh per atom) disusun dalam orbital dengan beberapa pusat yang direntangkan melintasi permukaan logam.
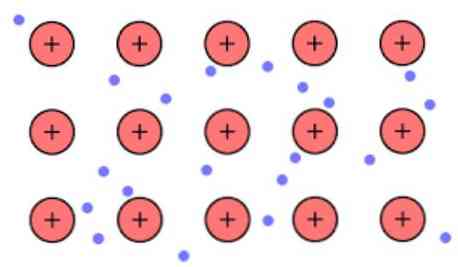
Juga, elektron mempertahankan beberapa lokasi dalam logam, meskipun distribusi probabilitas awan elektronik memiliki kerapatan yang lebih tinggi di sekitar beberapa atom tertentu. Hal ini disebabkan oleh kenyataan bahwa ketika menerapkan arus tertentu mereka menunjukkan konduktivitas mereka ke arah tertentu.
Indeks
- 1 Dasar-dasar teori lautan elektron
- 2 Properti
- 2.1 Offset dalam bentuk layer
- 2.2 Teori lautan elektron dalam kristal logam
- 3 Kerugian teori
- 4 Referensi
Dasar-dasar teori lautan elektron
Unsur-unsur logam memiliki kecenderungan besar untuk menyumbangkan elektron dari tingkat energi terakhir mereka (lapisan valensi), karena energi ionisasi mereka sangat rendah dalam kaitannya dengan unsur-unsur lainnya..
Mengetahui hal ini, setiap elemen logam dapat dianggap sebagai kation yang terkait dengan elektron dari tingkat energi terakhirnya, yang akan lebih rentan untuk disumbangkan..
Seperti dalam logam Anda memiliki sejumlah besar atom yang dihubungkan bersama, Anda dapat mengasumsikan bahwa logam ini membentuk sekelompok kation logam yang terbenam dalam semacam lautan elektron valensi yang memiliki offshoring besar.
Menimbang bahwa gaya tarik elektrostatik yang ada antara kation (muatan positif) dan elektron (muatan negatif) memiliki atom logam yang sangat terkait, ia membayangkan delokalisasi elektron valensi yang berperilaku sebagai perekat elektrostatik yang terus terikat ke kation logam.
Dengan cara ini, dapat disimpulkan bahwa semakin besar jumlah elektron yang ada di lapisan valensi logam, jenis perekat elektrostatik ini akan memiliki kekuatan yang lebih besar..
Properti
Teori lautan elektron menawarkan penjelasan sederhana tentang karakteristik spesies logam seperti resistensi, konduktivitas, daktilitas dan kelenturan, yang bervariasi dari satu logam ke logam lainnya..
Telah ditemukan bahwa resistansi yang diberikan pada logam disebabkan oleh delokalisasi elektron yang sangat besar, yang menghasilkan gaya kohesi yang sangat tinggi antara atom-atom yang membentuknya..
Dengan cara ini, daktilitas dikenal sebagai kemampuan bahan tertentu untuk memungkinkan deformasi struktur mereka, tanpa menghasilkan cukup untuk pecah, ketika mengalami kekuatan tertentu.
Offshoring dalam bentuk layer
Baik daktilitas dan kelenturan logam ditentukan oleh fakta bahwa elektron valensi terdelokalisasi ke segala arah dalam bentuk lapisan, yang menyebabkan mereka bergerak saling berhadapan di bawah aksi gaya eksternal, menghindari pemecahan struktur logam tetapi membiarkan deformasi.
Demikian juga, kebebasan bergerak dari elektron yang terdelokalisasi memungkinkan adanya aliran arus listrik, membuat logam memiliki konduktivitas listrik yang sangat baik..
Selain itu, fenomena pergerakan elektron bebas ini memungkinkan transfer energi kinetik antara berbagai wilayah logam, yang mempromosikan transmisi panas dan menyebabkan logam mewujudkan konduktivitas termal yang tinggi.
Teori lautan elektron dalam kristal logam
Kristal adalah zat padat yang memiliki sifat fisik dan kimia - seperti kerapatan, titik lebur, dan kekerasan - yang dibentuk oleh jenis kekuatan yang membuat partikel yang membuatnya tetap bersama..
Di satu sisi, dianggap bahwa kristal tipe logam memiliki struktur paling sederhana, karena setiap "titik" dari jaringan kristal telah ditempati oleh atom logam itu sendiri..
Dalam pengertian yang sama, telah ditentukan bahwa umumnya struktur kristal logam adalah kubik dan berfokus pada wajah atau tubuh..
Namun, spesies ini juga bisa berbentuk heksagonal dan memiliki kemasan yang cukup kompak, yang memberi mereka kepadatan yang luar biasa.
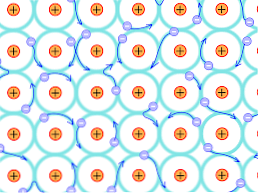
Karena alasan struktural ini, ikatan yang terbentuk dalam kristal logam berbeda dari yang terjadi pada jenis kristal lainnya. Elektron yang dapat membentuk ikatan terdelokalisasi di seluruh struktur kristal, seperti dijelaskan di atas.
Kerugian teori
Dalam atom logam ada sejumlah kecil elektron valensi sebanding dengan tingkat energinya; yaitu, ada sejumlah besar kondisi energi yang tersedia daripada jumlah elektron yang terhubung.
Ini menyiratkan bahwa, karena ada delokalisasi elektronik yang kuat dan juga pita-pita energi yang telah terisi sebagian, elektron dapat bergerak melalui struktur reticular ketika mereka mengalami medan listrik yang datang dari luar, selain membentuk lautan elektron yang mendukung permeabilitas jaringan.
Jadi penyatuan logam ditafsirkan sebagai konglomerat ion bermuatan positif ditambah dengan lautan elektron (bermuatan negatif).
Namun, ada karakteristik yang tidak dijelaskan oleh model ini, seperti pembentukan paduan tertentu antara logam dengan komposisi khusus atau stabilitas ikatan logam kolektif, antara lain..
Kelemahan ini dijelaskan oleh mekanika kuantum, karena teori ini dan banyak pendekatan lain telah dibuat berdasarkan model paling sederhana dari sebuah elektron tunggal, ketika mencoba untuk menerapkan struktur atom multielektronika yang jauh lebih kompleks..
Referensi
- Wikipedia. (2018). Wikipedia. Diperoleh dari en.wikipedia.org
- Holman, J. S., dan Stone, P. (2001). Kimia Diperoleh dari books.google.co.ve
- Parkin, G. (2010). Ikatan Logam-Logam. Diperoleh dari books.google.co.ve
- Rohrer, G. S. (2001). Struktur dan Ikatan pada Bahan Kristal. Diperoleh dari books.google.co.ve
- Ibach, H., dan Lut, H. (2009). Fisika Solid-State: Pengantar Prinsip Ilmu Material. Diperoleh dari books.google.co.ve


