Reaksi Saponifikasi dan Zat Yang Dapat Diperoleh
itu saponifikasi Ini adalah hidrolisis dasar ester. Ini berarti ester bereaksi dengan basa (NaOH atau KOH) secara ireversibel, menghasilkan alkohol dan karboksilat natrium atau kalium. Kata itu berarti "pembuatan sabun" dan, pada kenyataannya, adalah salah satu reaksi kimia tertua yang digunakan oleh umat manusia.
Pada zaman Babilonia, dengan bantuan abu yang dikumpulkan dari kayu dan tumbuhan serta lemak hewan, mereka menyempurnakan seni membuat sabun. Mengapa gemuk binatang? Alasannya adalah karena kaya akan triester gliserol (trigliserida), dan abu kayu adalah sumber kalium, logam dasar.
Jika tidak, reaksi berlanjut ke hasil yang lebih rendah, tetapi cukup untuk mencerminkan efeknya pada cat dan beberapa permukaan. Seperti halnya lukisan minyak, di mana pigmen dicampur dengan minyak (sumber ester).
Indeks
- 1 Reaksi saponifikasi
- 1.1 Mekanisme
- 1.2 Kinetika
- 2 Zat yang bisa diperoleh dengan saponifikasi
- 2.1 Tindakan pelarut sabun
- 3 Referensi
Reaksi saponifikasi
Mekanisme
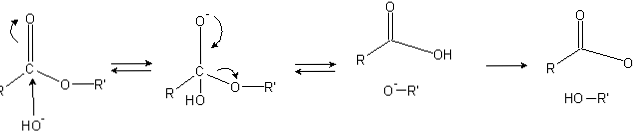
Ester memiliki gugus asil (O = C-R), yang rentan terhadap serangan nukleofilik seperti OH-.
Karena atom oksigen "mencuri" kerapatan elektronik dari atom karbon, ia bermuatan sebagian, lebih-lebih dalam kasus ester..
Akibatnya, muatan positif ini menarik spesies negatif yang mampu memasok elektron ke atom karbon, dengan serangan nukleofilik (sisi kiri gambar). Akibatnya, zat antara tetrahedral (molekul kedua dari kiri ke kanan) terbentuk.
Muatan negatif pada oksigen perantara tetrahedral adalah produk dari OH- sekitarnya Kemudian, muatan negatif ini didelokalisasi untuk berasal dari gugus karbonil, "memaksa" kemudian memutus ikatan C-OR. Juga, relokasi ini menghasilkan asam karboksilat RCOOH dan ion alkoksida R'O-.
Akhirnya, karena media reaksi bersifat basa, alkoksida mendeprotonasi satu molekul air dan asam karboksilat bereaksi dengan OH lainnya.- medium, menghasilkan produk saponifikasi.
Kinetika
Kecepatan reaksi saponifikasi sebanding dengan konsentrasi reaktan. Dengan kata lain, meningkatkan konsentrasi ester (RCOOR ') atau basa (NaOH), reaksi akan berlangsung pada tingkat yang lebih tinggi.
Ini juga diterjemahkan sebagai berikut: tingkat saponifikasi adalah urutan pertama sehubungan dengan ester, dan urutan pertama sehubungan dengan basis. Di atas dapat diekspresikan dengan persamaan matematika berikut:
Kecepatan = k [RCOOR '] [NaOH]
Di mana k adalah koefisien konstan atau kecepatan, yang bervariasi sebagai fungsi suhu atau tekanan; yaitu, semakin tinggi panas, semakin besar kecepatan saponifikasi. Untuk alasan ini, mediumnya dapat dididihkan.
Karena kedua reagen adalah kinetik orde pertama, reaksi keseluruhannya adalah orde kedua.
Dalam mekanisme reaksi saponifikasi, pembentukan zat antara tetrahedral memerlukan serangan nukleofilik, yang melibatkan ester dan basa.
Dengan demikian, kinetika orde kedua tercermin dalam fakta ini, karena mereka campur tangan dalam langkah penentu reaksi (lambat).
Zat yang bisa didapat dengan saponifikasi

Produk utama saponifikasi adalah alkohol dan garam asam karboksilat. Dalam media asam, masing-masing RCOOH, diperoleh dengan saponifikasi lemak dan minyak, yang dikenal sebagai asam lemak, diperoleh..
Dengan cara ini, sabun terdiri dari garam-garam asam lemak yang dihasilkan dari saponifikasi. Apakah Anda pergi dengan kation apa? Mereka bisa menjadi Na+, K+, Mg2+, Iman3+, dll..
Garam-garam ini larut dalam air, tetapi diendapkan oleh aksi NaCl yang ditambahkan ke dalam campuran, yang mengeringkan sabun dan memisahkannya dari fase berair. Reaksi saponifikasi untuk trigliserida adalah sebagai berikut:
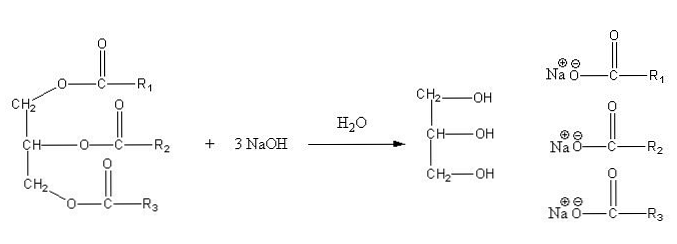
Gliserin adalah alkohol "E", dan sabun adalah semua garam dari asam lemak yang dihasilkan. Di sini, setiap sidechain -R memiliki panjang dan tingkat jenuh yang berbeda. Akibatnya, rantai ini membuat perbedaan antara lemak dan minyak nabati.
Kunci untuk pembuatan sabun terletak pada pemilihan lemak dan minyak terbaik, atau lebih khusus lagi, dalam pemilihan berbagai sumber trigliserida..
Massa sabun putih ini dapat mengandung pewarna dan senyawa organik lainnya dalam strukturnya, memberikan aroma menyenangkan dan warna-warna cerah. Dari sini, berbagai kemungkinan dijinakkan oleh seni dan panggilan dalam perdagangan ini.
Namun, reaksi saponifikasi juga merupakan rute sintetis dari asam karboksilat dan alkohol yang tidak harus dilakukan dengan gliserin atau sabun..
Misalnya, hidrolisis dasar ester apa pun, seperti etil asetat sederhana, akan menghasilkan asam asetat dan etanol..
Aksi pelarut sabun

Garam dari asam lemak larut dalam air, tetapi tidak dengan cara yang sama seperti ion dilarutkan; yaitu dikelilingi oleh bola berair. Dalam hal sabun, rantai sampingnya - R secara teori mencegah mereka larut dalam air.
Oleh karena itu, untuk mengatasi posisi yang sangat tidak nyaman ini, mereka diorientasikan sedemikian rupa sehingga rantai ini bersentuhan, membentuk inti organik apolar, sedangkan kepala kutub, ujung (-COO)- Na+), berinteraksi dengan molekul air dan membuat "cangkang kutub".
Di atas diilustrasikan pada gambar di atas, di mana jenis struktur yang dikenal sebagai misel ditunjukkan.
"Ekor hitam" berhubungan dengan rantai hidrofobik, menjadi terjerat dalam inti organik yang dilindungi oleh bola abu-abu. Bola abu-abu ini membentuk perisai kutub, kepala -COO- Na+.
Kemudian, misel adalah kluster (kluster) dari garam-garam asam lemak. Di dalamnya mereka dapat melampirkan lemak, yang tidak larut dalam air karena sifat apolarnya.
Bagaimana mereka melakukannya? Baik rantai lemak dan -R bersifat hidrofobik, sehingga keduanya memiliki afinitas yang besar satu sama lain.
Ketika misel menutupi lemak, air berinteraksi dengan kulit polar, memungkinkan kelarutan sabun. Demikian juga, misel bermuatan negatif, menyebabkan jijik satu sama lain dan, karenanya, menghasilkan dispersi lemak.
Referensi
- Anne Marie Helmenstine, Ph.D. (3 Oktober 2017). Definisi dan Reaksi Saponifikasi. Diperoleh pada 24 April 2018, dari: thoughtco.com
- Francis A. Carey. Kimia Organik Asam karboksilat. (edisi keenam., hlm. 863-866). Mc Graw Hill.
- Graham Solomons TW., Craig B. Fryhle. Kimia Organik. Lipid (edisi ke-10., Halaman 1056-1058). Wiley Plus.
- Wikipedia. (2018). Saponifikasi. Diperoleh pada 24 April 2018, dari: en.wikipedia.org
- Boyd C. (27 Februari 2015). Memahami kimia dan sejarah sabun. Diperoleh pada 24 April 2018, dari: chemservice.com
- Luca Laghi (27 Maret 2007). Saponifikasi. Diperoleh pada 24 April 2018, dari: commons.wikimedia.org
- Amanda Crochet (12 Mei 2015). Micelle (grayscale). Diperoleh pada 24 April 2018, dari: commons.wikimedia.org


