Karakteristik dan Keterbatasan Model Atom Broglie
itu Model atom Broglie diusulkan oleh fisikawan Perancis Louis Broglie pada tahun 1924. Dalam tesis doktoralnya, Broglie menegaskan dualitas gelombang-partikel elektron, meletakkan dasar-dasar mekanika gelombang. Broglie menerbitkan temuan-temuan teoretis penting tentang sifat sel-gelombang materi pada skala atom.
Selanjutnya, pernyataan Broglie secara eksperimental ditunjukkan oleh para ilmuwan Clinton Davisson dan Lester Germer, pada tahun 1927. Teori gelombang elektron Broglie didasarkan pada proposal Einstein tentang sifat-sifat gelombang cahaya pada panjang gelombang pendek..
Broglie mengumumkan kemungkinan bahwa materi memiliki perilaku yang mirip dengan cahaya, dan menyarankan sifat yang serupa dalam partikel subatom seperti elektron.
Muatan dan orbit listrik membatasi amplitudo, panjang, dan frekuensi gelombang yang dijelaskan oleh elektron. Broglie menjelaskan pergerakan elektron di sekitar inti atom.
Indeks
- 1 Karakteristik model atom Broglie
- 2 percobaan Davisson dan Germer
- 3 Keterbatasan
- 4 Artikel menarik
- 5 Referensi
Karakteristik model atom Broglie
Untuk mengembangkan proposalnya, Broglie memulai dari prinsip bahwa elektron memiliki sifat ganda antara gelombang dan partikel, mirip dengan cahaya.
Dalam pengertian ini, Broglie membuat perbandingan antara kedua fenomena, dan berdasarkan pada persamaan yang dikembangkan oleh Einstein untuk studi sifat gelombang cahaya, ia menunjukkan yang berikut:
- Energi total foton dan, akibatnya, energi total elektron, dihasilkan dari produk frekuensi gelombang dan konstanta Plank (6.62606957 (29) × 10 -34 Jules x detik), sebagaimana dirinci dalam ungkapan berikut:
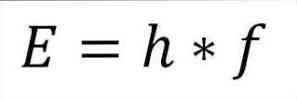
Dalam ungkapan ini:
E = energi elektron.
h = Konstanta papan.
f = frekuensi gelombang.
- Momen linear foton, dan karenanya, elektron, berbanding terbalik dengan panjang gelombang, dan kedua magnitudo dihubungkan melalui konstanta Plank:
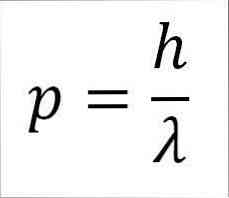
Dalam ungkapan ini:
p = momen linear dari elektron.
h = Konstanta papan.
λ = panjang gelombang.
- Momentum linier adalah produk dari massa partikel dengan kecepatan yang dimiliki partikel selama perpindahannya.
Jika ekspresi matematika sebelumnya direstrukturisasi sebagai fungsi panjang gelombang, kami memiliki yang berikut:
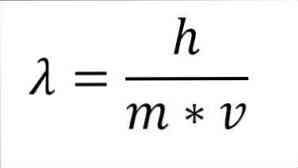
Dalam ungkapan tersebut:
λ = panjang gelombang.
h = Konstanta papan.
m = massa elektron.
v = kecepatan elektron.
Karena h, konstanta Plank, memiliki nilai kecil, panjang gelombang λ juga. Akibatnya, layak untuk menyatakan bahwa sifat gelombang elektron hanya terjadi pada tingkat atom dan subatomik.
- Broglie juga didasarkan pada postulat model atom Bohr. Menurut yang terakhir, orbit elektron terbatas dan hanya bisa kelipatan bilangan bulat. Demikian:
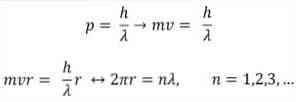
Dimana:
λ = panjang gelombang.
h = Konstanta papan.
m = massa elektron.
v = kecepatan elektron.
r = jari-jari orbit.
n = bilangan bulat.
Menurut model atom Bohr, yang diadopsi Broglie sebagai basis, jika elektron berperilaku seperti gelombang berdiri, satu-satunya orbit yang diizinkan adalah mereka yang radiusnya sama dengan kelipatan integral panjang gelombang λ.
Oleh karena itu, tidak semua orbit memenuhi parameter yang diperlukan agar elektron dapat melewatinya. Itu sebabnya elektron hanya dapat bergerak dalam orbit tertentu.
Teori gelombang elektron Broglie membenarkan keberhasilan model atom Bohr untuk menjelaskan perilaku elektron tunggal dari atom hidrogen.
Secara analog, juga menjelaskan mengapa model ini tidak cocok dengan sistem yang lebih kompleks, yaitu atom dengan lebih dari satu elektron.
Eksperimen Davisson dan Germer
Verifikasi eksperimental model atom Broglie berlangsung 3 tahun setelah publikasi, pada tahun 1927.
Fisikawan terkemuka Amerika, Clinton J. Davisson dan Lester Germer, secara eksperimental mengkonfirmasi teori mekanika gelombang.
Davisson dan Germer melakukan uji hamburan sinar elektron melalui kristal nikel dan mengamati fenomena difraksi melalui media logam.
Percobaan yang dilakukan terdiri dari melaksanakan prosedur berikut:
- Dalam contoh pertama, sebuah perakitan dengan berkas elektron ditempatkan yang memiliki energi awal yang diketahui.
- Sumber tegangan dipasang untuk mempercepat pergerakan elektron, mendorong perbedaan potensial.
- Aliran berkas elektron diarahkan ke kristal logam; dalam hal ini, nikel.
- Jumlah elektron yang berdampak pada kristal nikel diukur.
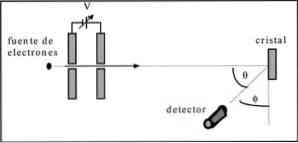
Pada akhir percobaan, Davisson dan Germer mendeteksi bahwa elektron terdispersi dalam arah yang berbeda.
Dengan mengulangi percobaan menggunakan kristal logam dengan orientasi yang berbeda, para ilmuwan mendeteksi hal-hal berikut:
- Dispersi sinar elektron melalui kristal logam sebanding dengan fenomena interferensi dan difraksi sinar cahaya..
- Refleksi elektron pada kristal tumbukan menggambarkan lintasan yang, secara teoritis, harus menggambarkan menurut teori gelombang elektron Broglie.
Dalam sintesis, percobaan Davisson dan Germer secara eksperimental membuktikan sifat gelombang-partikel ganda dari elektron.
Keterbatasan
Model atom Broglie tidak memprediksi lokasi pasti elektron pada orbit tempat ia bergerak.
Dalam model ini, elektron dianggap sebagai gelombang yang bergerak di sekitar orbit tanpa lokasi tertentu, yang memperkenalkan konsep orbital elektronik..
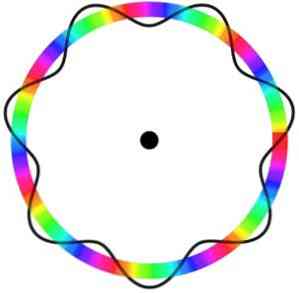
Selain itu, model atom Broglie, analog dengan model Schrödinger, tidak mempertimbangkan rotasi elektron pada porosnya (berputar).
Dengan mengabaikan momentum sudut intrinsik elektron, variasi spasial dari partikel-partikel subatomik ini diabaikan..
Dalam urutan gagasan yang sama, model ini tidak memperhitungkan perubahan dalam perilaku elektron cepat sebagai konsekuensi dari efek relativistik..
Artikel menarik
Model atom Schrödinger.
Model atom Chadwick.
Model atom Heisenberg.
Model atom Perrin.
Model atom Thomson.
Model atom Dalton.
Model atom Dirac Jordan.
Model atom dari Democritus.
Model atom Bohr.
Referensi
- Teori Kuantum Bohr dan Gelombang De Broglie (s.f.). Diperoleh dari: ne.phys.kyushu-u.ac.j
- Louis de Broglie - Biografis (1929). © Yayasan Nobel. Diperoleh dari: nobelprize.org
- Louis-Victor de Broglie (s.f.) Diperoleh dari: chemed.chem.purdue.edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Diperoleh dari: britannica.com
- Model atom De Broglie. Universitas Nasional Pendidikan Jarak Jauh. Spanyol Diperoleh dari: ocw.innova.uned.es
- Gelombang Masalah Louis De Broglie (s.f.). Diperoleh dari: hiru.eus
- Von Pamel, O., dan Marchisio, S. (s.f.). Mekanika kuantum Universitas Nasional Rosario. Diperoleh dari: fceia.unr.edu.ar


