Properti, Reaktivitas dan Kegunaan Kalsium Hidrida (CaH2)
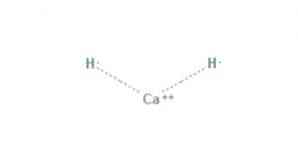
itu kalsium hidrida adalah senyawa kimia formula CaH2, yang membuatnya menjadi alkali tanah hidrida. Senyawa kimia ini memiliki dua ikatan ion antara kalsium dan dua ion hidrida, seperti yang ditunjukkan pada Gambar 1.
Ini adalah hidrida salin, yang berarti bahwa strukturnya mirip dengan garam. Struktur kristalnya sama dengan timbal klorida (mineral Cotunnite) seperti yang ditunjukkan pada Gambar 2.

Semua logam alkali dan alkali tanah membentuk garam hidrida. Dalam kimia, hidrida adalah anion hidrogen, H- atau, lebih umum, senyawa di mana satu atau lebih pusat hidrogen memiliki sifat nukleofilik, pereduksi atau basa.
Dalam senyawa yang dianggap hidrida, atom hidrogen melekat pada elemen atau kelompok yang lebih elektropositif.
Ini dapat diproduksi dengan mereaksikan kalsium dan hidrogen pada suhu antara 300 dan 400 derajat celcius. Cara lain untuk menyiapkan kalsium hidrida adalah memanaskan kalsium klorida bersama dengan hidrogen dan logam natrium. Reaksi terjadi sebagai berikut:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Dalam reaksi ini kalsium (Ca) dan hidrogen (H) membuat molekul kalsium hidrida, sedangkan atom natrium bersama dengan klor menghasilkan molekul natrium klorida (NaCl).
Kalsium hidrida juga dapat diproduksi dengan mengurangi kalsium oksida (CaO) dengan magnesium (Mg). Reaksi dilakukan dengan adanya hidrogen. Reaksi ini juga menghasilkan magnesium oksida (MgO). Di bawah ini adalah rumus untuk reaksi kimia ini:
CaO + Mg + H2 → CaH2 + MgO
Indeks
- 1 Sifat fisik dan kimia kalsium hidrida
- 2 Reaktivitas dan bahaya
- 3 Penanganan dan penyimpanan
- 4 Penggunaan dan aplikasi
- 4.1 Agen pengering
- 4.2 Produksi hidrogen
- 4.3 Agen pereduksi
- 5 Kerugian dalam penggunaan kalsium hidrida
- 6 Referensi
Sifat fisik dan kimia kalsium hidrida
Kalsium hidrida adalah seperangkat kristal dengan struktur ortorombik putih ketika murni. Umumnya, jarang ditemukan dalam bentuk ini sehingga biasanya memiliki rona keabu-abuan. Itu tidak memiliki bau khas. Penampilannya ditunjukkan pada Gambar 3 (Royal Society of Chemistry, 2015).

Ini memiliki berat molekul 42.094 g / mol, memiliki titik leleh 816 derajat Celcius dan kepadatan 1,70 g / ml. Jika larut dalam air, ia bereaksi keras menghasilkan hidrogen. Ini juga bereaksi dengan alkohol (Pusat Nasional untuk Informasi Bioteknologi., S.F.).
Reaktivitas dan bahaya
Kalsium hidrida adalah bahan kimia yang stabil, meskipun sangat reaktif terhadap air atau uap air. Dalam kontak dengan air, ia melepaskan gas hidrogen yang mudah terbakar yang dapat menyala secara spontan.
Itu dianggap senyawa peledak. Ketika dipanaskan dalam suatu reaksi dengan tetrahydrofuran, itu dapat menyebabkan ledakan. Ketika dicampur dengan klorat, hipoklorit, bromat, kalium perklorat, menjadi peka terhadap panas, gesekan, dan menjadi mudah meledak (Calcium Hydride 7789-78-8, 2016).
Ketika perak fluoride dihancurkan dengan kalsium hidrida, massa menjadi pijar. Pemanasan kuat hidrida dengan klorin, bromin, atau yodium menyebabkan pijar.
Campuran hidrida dengan berbagai bromat, misalnya barium bromat atau klorat, misalnya barium klorat dan perklorat seperti kalium perklorat, meledak pada saat triturasi. CaH2 bereaksi pijar dengan perak fluorida jika mengalami gesekan.
Senyawa ini harus ditangani dalam suasana lembam. Jika tidak ditangani dengan benar, ini dapat menimbulkan ancaman serius bagi kesehatan dan keselamatan personel laboratorium, penjaga pantai, dan penangan limbah kimia (Pusat UC untuk keselamatan laboratorium, 2013).
Sangat berbahaya jika terjadi kontak dengan kulit atau mata, karena dapat menyebabkan iritasi. Sangat berbahaya jika terjadi kontak dengan kulit karena dapat bersifat korosif.
Juga berbahaya jika tertelan dan terhirup. Jumlah kerusakan jaringan tergantung pada panjang kontak. Kontak dengan mata dapat menyebabkan kerusakan kornea atau kebutaan.
Kontak dengan kulit dapat menyebabkan peradangan dan lepuh. Menghirup debu akan menghasilkan iritasi pada saluran pencernaan atau pernapasan, ditandai dengan rasa terbakar, bersin, dan batuk..
Paparan berlebih yang parah dapat menyebabkan kerusakan paru-paru, mati lemas, tidak sadar dan bahkan kematian. Peradangan mata ditandai dengan kemerahan, iritasi dan gatal. Peradangan pada kulit ditandai dengan rasa gatal, mengelupas, kemerahan, atau kadang-kadang melepuh.
Paparan mata yang berulang ke tingkat yang rendah dapat menyebabkan iritasi mata. Paparan berulang pada kulit dapat menyebabkan kerusakan kulit lokal, atau dermatitis.
Menghirup debu berulang-ulang dapat menghasilkan tingkat iritasi pernapasan yang bervariasi atau kerusakan paru-paru. Menghirup debu berulang atau berkepanjangan dapat menyebabkan iritasi pernafasan kronis (Material Safety Data Sheet Calcium hydride MSDS, 2005).
Dalam kasus kontak dengan mata, mereka harus segera dibilas dengan banyak air selama minimal 15 menit, kadang-kadang mengangkat kelopak mata atas dan bawah.
Dalam kasus kontak kulit harus segera dibilas dengan banyak air selama setidaknya 15 menit sambil melepaskan pakaian dan sepatu yang terkontaminasi.
Jika tertelan, muntah tidak boleh diinduksi. Pusat pengendalian racun harus disebut. Dianjurkan untuk meninggalkan situs pameran dan segera pindah ke luar.
Jika terhirup, jika sulit bernafas, maka perlu suplai oksigen. Pernapasan mulut ke mulut tidak boleh diberikan jika korban menelan atau menghirup zat tersebut.
Respirasi buatan harus diinduksi dengan bantuan masker saku yang dilengkapi dengan katup searah atau perangkat medis pernapasan lainnya yang sesuai. Dalam semua kasus, perhatian medis harus diperoleh segera.
Penanganan dan penyimpanan
Senyawa harus disimpan dalam wadah kering agar tidak panas. Itu harus dijauhkan dari sumber api. Jangan menghirup debu. Tidak ada air yang ditambahkan ke produk ini
Jika ventilasi tidak memadai, pakai peralatan pernapasan yang sesuai seperti saringan masker. Jika terpapar, Anda harus mencari perhatian medis dan menunjukkan label sebanyak mungkin. Hindari kontak dengan kulit dan mata.
Bahan yang mudah terbakar, secara umum, harus disimpan di kabinet keamanan atau ruang penyimpanan yang terpisah. Jaga agar wadah tertutup rapat.
Simpan di tempat yang dingin dan berventilasi baik. Semua peralatan yang mengandung bahan untuk menghindari percikan listrik harus dibumikan. Wadah harus tetap kering dan di tempat yang dingin.
Ini adalah bahan yang tidak mudah terbakar. Namun, petugas pemadam kebakaran harus mengenakan peralatan yang tepat sambil memadamkan api di sekitar senyawa kimia ini.
Tidak pernah dianjurkan menggunakan air untuk memadamkan api di sekitar kalsium hidrida. Pasir kering dapat digunakan, juga senyawa seperti natrium klorida dan natrium karbonat untuk tujuan ini.
Untuk menghilangkan limbah kalsium hidrida, harus didekomposisi dengan menambahkan 25 ml metanol untuk setiap gram hidrida dalam atmosfer nitrogen sambil diaduk.
Setelah reaksi selesai, volume air yang sama ditambahkan ke senyawa kalsium metoksida berair dan dibuang ke saluran pembuangan dengan banyak air (National Research Council, 1995)..
Penggunaan dan aplikasi
Agen pengering
Potasium hidrida adalah desikan yang relatif ringan. Karena alasan ini, penggunaan senyawa ini sebagai desikan lebih aman dibandingkan dengan agen yang lebih reaktif, seperti natrium-kalium dan paduan logam natrium. Bereaksi dengan air dengan cara berikut:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Produk hidrolisis dari reaksi ini, hidrogen (gas) dan Ca (OH) 2 (campuran berair), dapat dipisahkan dari pelarut kimia setelah proses filtrasi, distilasi atau dekantasi.
Senyawa kimia ini adalah desikan yang efektif untuk banyak pelarut dasar seperti amina dan piridin. Kadang-kadang digunakan untuk pra-kering pelarut sebelum menggunakan desikan yang lebih reaktif.
Produksi hidrogen
Pada tahun 1940-an, senyawa ini tersedia sebagai sumber hidrogen dengan nama dagang "Hydrolith".
Telah digunakan sebagai sumber hidrogen untuk waktu yang lama. Itu masih digunakan untuk menghasilkan hidrogen murni di laboratorium untuk berbagai percobaan, sel bahan bakar canggih dan aplikasi baterai (American Elements, S.F.).
Senyawa ini telah banyak digunakan selama beberapa dekade sebagai cara yang aman dan nyaman untuk menggembungkan balon cuaca.
Demikian juga, secara teratur digunakan di laboratorium untuk menghasilkan sejumlah kecil hidrogen yang sangat murni untuk percobaan. Kadar air dari bahan bakar diesel dihitung oleh hidrogen yang dikembangkan setelah perawatan dengan CaH2.
Agen pereduksi
Ketika dipanaskan antara 600 dan 1000 derajat Celcius, zirkonium oksida, niobium, uranium, kromium, titanium, vanadium dan tantalum dapat dikurangi untuk menyiapkan bubuk logam ini, sehingga kalsium hidrida dapat digunakan dalam metalurgi debu.
Reaksi berikut menggambarkan cara kalsium hidrida bertindak sebagai zat pereduksi:
TiO + 2CaH2 → CaO + H2 + Ti
Kerugian dalam penggunaan kalsium hidrida
Senyawa kimia ini sering merupakan pilihan yang disukai sebagai bahan pengering; Namun, ia juga memiliki beberapa kelemahan:
-Tindakan pengeringan senyawa ini lambat, karena tidak larut dalam pelarut apa pun yang tidak bereaksi dengan keras.
-Senyawa serbuk ini tidak kompatibel dengan banyak pelarut. Reaksi Anda dengan klorokarbon bahkan dapat menyebabkan ledakan.
-Ini tidak dapat digunakan untuk pelarut deoksigenasi, karena tidak mampu menghilangkan oksigen terlarut.
-Membedakan antara kalsium hidrida dan kalsium hidroksida cukup sulit karena penampilannya yang serupa.
Referensi
- Elemen Amerika. (S.F.). kalsium hidrida. Diperoleh dari americanelements.com: americanelements.com.
- Kalsium Hidrida 7789-78-8. (2016). Diperoleh dari chemicalbook.com: chemicalbook.com.
- kalsium hidrida. (s.f.). Diperoleh dari pelajar kimia: chemistrylearner.com.
- Lembar Data Keselamatan Bahan Kalsium hidrida MSDS. (2005, 10 Oktober). Diperoleh dari sciencelab.com: sciencelab.com.
- Pusat Nasional untuk Informasi Bioteknologi. (S.F.). Basis Data Gabungan PubChem; CID = 105052. Diperoleh dari pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- dewan penelitian nasional. (1995). Praktik yang Prudent di Laboratorium: Penanganan dan Pembuangan Bahan Kimia. Washinton: NationalAcademy Press.
- Royal Society of Chemistry. (2015). calcium hydride ID 94784. Diperoleh dari chemspider.com: chemspider.com.
- Pusat UC untuk keamanan laboratorium. (2013, 18 Januari). prosedur operasi standar kalsium hidrida. Diperoleh dari chemengr.ucsb.edu: chemengr.ucsb.edu.


