Kalsium fosfat (Ca3 (PO4) 2) struktur, sifat, pembentukan dan penggunaan
itu kalsium fosfat adalah garam anorganik dan tersier yang rumus kimianya adalah Ca3(PO4)2. Rumus menyatakan bahwa komposisi garam ini adalah 3: 2 untuk kalsium dan fosfat, masing-masing. Ini dapat dilihat langsung pada gambar bawah, di mana kation ditampilkan2+ dan anion PO43-. Untuk setiap tiga Ca2+ Ada dua PO43- berinteraksi dengan mereka.
Di sisi lain, kalsium fosfat mengacu pada serangkaian garam yang bervariasi tergantung pada rasio Ca / P, serta tingkat hidrasi dan pH. Faktanya, ada banyak jenis kalsium fosfat yang ada dan dapat disintesis. Namun, mengikuti nomenklatur secara harfiah, kalsium fosfat hanya merujuk pada trikalsium, yang disebutkan di atas.

Semua kalsium fosfat, termasuk Ca3(PO4)2, Warnanya putih pekat dengan nada agak keabu-abuan. Mereka bisa granular, halus, kristal, dan memiliki ukuran partikel sekitar mikrometer; dan bahkan, partikel nano dari fosfat ini telah disiapkan, dengan mana bahan biokompatibel untuk tulang dirancang.
Biokompatibilitas ini disebabkan oleh fakta bahwa garam-garam ini ditemukan di gigi dan, singkatnya, di jaringan tulang mamalia. Misalnya, hidroksiapatit adalah kalsium fosfat kristal, yang pada gilirannya berinteraksi dengan fase amorf dari garam yang sama.
Ini berarti ada kalsium fosfat amorf dan kristal. Karena alasan ini, keanekaragaman dan banyak pilihan tidak mengejutkan ketika mensintesis bahan yang didasarkan pada kalsium fosfat; bahan yang sifatnya peneliti lebih tertarik setiap hari di seluruh dunia untuk fokus pada pemulihan tulang.
Indeks
- 1 Struktur kalsium fosfat
- 1.1 Kalsium fosfat amorf
- 1.2 Anggota keluarga lainnya
- 2 Sifat fisik dan kimia
- 2.1 Nama
- 2.2 Berat molekul
- 2.3 Deskripsi fisik
- 2.4 Rasa
- 2.5 Titik lebur
- 2.6 Kelarutan
- 2,7 Kepadatan
- 2.8 Indeks bias
- 2.9 Entalpi pelatihan standar
- 2.10 Suhu penyimpanan
- 2,11 pH
- 3 Pelatihan
- 3.1 Kalsium nitrat dan amonium hidrogen fosfat
- 3.2 Kalsium hidroksida dan asam fosfat
- 4 Penggunaan
- 4.1 Di dalam jaringan tulang
- 4.2 Semen Bioceramic
- 4.3 Dokter
- 4.4 Lainnya
- 5 Referensi
Struktur kalsium fosfat
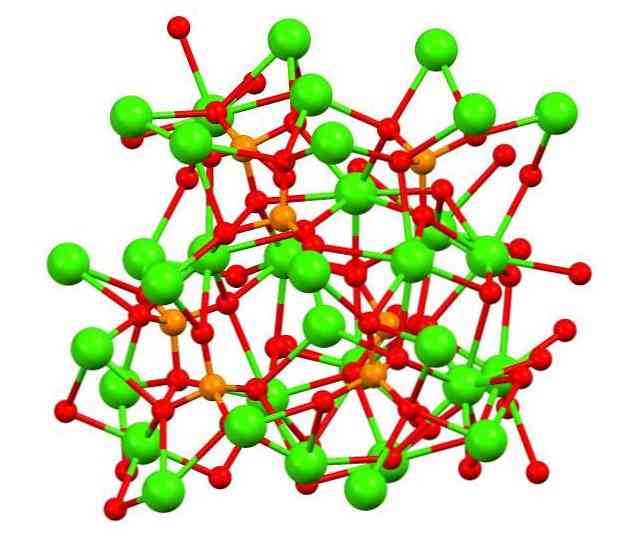
Gambar atas menunjukkan struktur calico phosphate tribasic dalam mineral whitlockite yang aneh, yang mungkin mengandung magnesium dan zat besi sebagai pengotor..
Meskipun pada pandangan pertama mungkin tampak rumit, perlu diperjelas bahwa model mengasumsikan interaksi kovalen antara atom oksigen dari fosfat dan pusat logam kalsium.
Akan tetapi, dengan cara representasi itu valid, interaksinya bersifat elektrostatik; yaitu, kation Ca2+ tertarik pada anion PO43- (Ca2+- O-PO33-). Dengan pemikiran ini, dipahami mengapa dalam gambar kalsium (bola hijau) dikelilingi oleh atom oksigen bermuatan negatif (bola merah).
Ketika ada begitu banyak ion, tidak meninggalkan pengaturan atau pola simetris yang terlihat. Ca3(PO4)2 Mengadopsi pada suhu rendah (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, untuk akronimnya dalam bahasa Inggris).
Pada suhu tinggi, di sisi lain, ia diubah menjadi polimorf α-Ca3(PO4)2 (α-TCP), yang sel unitnya berhubungan dengan sistem kristal monoklinik. Pada suhu yang lebih tinggi lagi, polymorph α'-Ca juga dapat dibentuk3(PO4)2, yang merupakan struktur kristal heksagonal.
Kalsium fosfat amorf
Struktur kristal telah disebutkan untuk kalsium fosfat, yang diharapkan dari garam. Namun, ia mampu menunjukkan struktur yang tidak teratur dan asimetris, lebih terkait dengan jenis "kaca kalsium fosfat" daripada kristal dalam arti definisi yang ketat..
Ketika ini terjadi, dikatakan bahwa kalsium fosfat memiliki struktur amorf (ACP, kalsium fosfat amorf). Beberapa penulis menunjuk pada jenis struktur ini sebagai penyebab sifat biologis Ca3(PO4)2 dalam jaringan tulang, perbaikan dan biomimetisasi dimungkinkan.
Melalui penjelasan strukturnya dengan resonansi magnetik nuklir (NMR), keberadaan ion OH telah ditemukan- dan HPO42- di ACP. Ion-ion ini dibentuk oleh hidrolisis salah satu fosfat:
PO43- + H2O <=> HPO42- + OH-
Akibatnya, struktur ACP yang sebenarnya menjadi lebih kompleks, yang komposisi ionnya diwakili oleh rumus: Ca9(PO4)6-x(HPO4)x(OH)x. Tanda 'x' menunjukkan tingkat hidrasi, karena jika x = 1, maka rumusnya adalah sebagai: Ca9(PO4)5(HPO4) (OH).
Struktur berbeda yang tergantung pada PCA pada rasio molar Ca / P; yaitu, dari jumlah relatif kalsium dan fosfat, yang mengubah semua komposisi yang dihasilkannya.
Anggota keluarga lainnya
Kalsium fosfat sebenarnya adalah keluarga senyawa anorganik, yang pada gilirannya dapat berinteraksi dengan matriks organik.
Fosfat lain diperoleh "sederhana" dengan mengubah anion yang menyertai kalsium (PO43-, HPO42-, H2PO4-, OH-), serta jenis kotoran dalam padatan. Dengan demikian, hingga sebelas kalsium fosfat atau lebih, masing-masing dengan struktur dan sifatnya sendiri, dapat berasal secara alami atau buatan..
Di bawah ini adalah beberapa fosfat dan masing-masing struktur dan formula kimianya:
-Hidrogen kalsium fosfat dihidrat, CaHPO4∙ 2H2O: monoklinik.
-Kalsium dihidrogen fosfat monohidrat, Ca (H)2PO4)2∙ H2O: triklinik.
-Fosfat diasid anhidrat, Ca (H)2PO4)2: triklinik.
-Ocalcium hydrogen phosphate (OCP), Ca8H2(PO4)6: triklinik Ini adalah prekursor dalam sintesis hidroksiapatit.
-Hidroksiapatit, Ca5(PO4)3OH: heksagonal.
Sifat fisik dan kimia
Nama
-Kalsium fosfat
-Tricalcium fosfat
-Tricalcium diphosphate
Berat molekul
310,74 g / mol.
Deskripsi fisik
Ini adalah padatan putih tidak berbau.
Rasa
Hambar.
Titik lebur
1670 ºK (1391 ºC).
Kelarutan
-Praktis tidak larut dalam air.
-Tidak larut dalam etanol.
-Larut dalam asam klorida encer dan asam nitrat.
Kepadatan
3,14 g / cm3.
Indeks bias
1,629
Entalpi pelatihan standar
4126 kkal / mol.
Suhu penyimpanan
2-8 ºC.
pH
6-8 dalam suspensi berair 50 g / L kalsium fosfat.
Pelatihan
Kalsium nitrat dan hidrogen amonium fosfat
Ada banyak metode untuk menghasilkan atau membentuk kalsium fosfat. Salah satunya terdiri dari campuran dua garam, Ca (TIDAK)3)2∙ 4H2O, dan (NH4)2HPO4, sebelumnya dilarutkan dalam alkohol dan air absolut, masing-masing. Satu garam menyediakan kalsium, dan yang lain fosfat.
Dari campuran ini endapan ACP, yang kemudian dipanaskan dalam oven pada suhu 800 ° C dan selama 2 jam. Sebagai hasil dari prosedur ini, β-Ca diperoleh3(PO4)2. Dengan hati-hati mengendalikan suhu, agitasi dan waktu kontak, pembentukan nanocrystal dapat terjadi.
Untuk membentuk polymorph α-Ca3(PO4)2 perlu memanaskan fosfat di atas 1000 ° C. Pemanasan ini dilakukan dengan adanya ion logam lain, yang menstabilkan polimorf ini secukupnya untuk digunakan pada suhu kamar; yaitu, ia tetap dalam kondisi meta yang stabil.
Kalsium hidroksida dan asam fosfat
Kalsium fosfat juga dapat dibentuk dengan mencampurkan larutan kalsium hidroksida dan asam fosfat, dengan netralisasi asam basa. Setelah setengah hari pemasakan dalam cairan induk, dan dari filtrasi yang tepat, pencucian, pengeringan dan pengayakan, bubuk granular fosfat amorf diperoleh, ACP.
Produk reaksi ACP ini dari suhu tinggi, mengubah menurut persamaan kimia berikut:
2Ca9(HPO4) (PO4)5(OH) => 2Ca9(P2O7)0,5(PO4)5(OH) + H2O (pada T = 446,60 ° C)
2Ca9(P2O7)0,5(PO4)5(OH) => 3Ca3(PO4)2 + 0,5 jam2O (pada T = 748.56 ° C)
Dengan cara ini, β-Ca diperoleh3(PO4)2, polimorf yang paling umum dan stabil.
Penggunaan
Di jaringan tulang
Ca3(PO4)2 Ini adalah konstituen anorganik utama dari abu tulang. Ini adalah komponen dari transplantasi pengganti tulang, ini dijelaskan oleh kesamaan kimianya dengan mineral yang ada di tulang.
Biomaterial kalsium fosfat digunakan untuk memperbaiki kerusakan tulang dan pada lapisan protesa logam titanium. Kalsium fosfat disimpan pada mereka, mengisolasi mereka dari lingkungan dan memperlambat proses korosi titanium.
Kalsium fosfat, termasuk Ca3(PO4)2, Mereka digunakan untuk produksi bahan keramik. Bahan-bahan ini biokompatibel, dan saat ini digunakan untuk mengembalikan kehilangan tulang alveolar, yang dihasilkan dari penyakit periodontal, infeksi endodontik dan kondisi lainnya..
Namun, mereka hanya boleh digunakan untuk mempercepat perbaikan tulang periapikal, di daerah di mana tidak ada infeksi bakteri kronis.
Kalsium fosfat dapat digunakan untuk memperbaiki kerusakan tulang, ketika tidak mungkin menggunakan cangkok tulang autogenous. Adalah mungkin untuk menggunakannya sendiri atau dalam kombinasi dengan polimer yang dapat terbiodegradasi dan dapat diserap, seperti asam poliglikolat.
Semen bioceramic
Semen kalsium fosfat (BPK) adalah bioceramic lain yang digunakan dalam perbaikan jaringan tulang. Itu dibuat dengan mencampur bubuk berbagai jenis kalsium fosfat dengan air, membentuk pasta. Pasta dapat disuntikkan atau disesuaikan dengan cacat atau rongga tulang.
Semen dicetak, secara bertahap diserap dan diganti dengan tulang yang baru terbentuk.
Dokter
-Ca3(PO4)2 Ini adalah garam dasar, sehingga digunakan sebagai antasida untuk menetralkan asam lambung berlebih dan meningkatkan pH. Dalam pasta gigi, ia menyediakan sumber kalsium dan fosfat untuk memfasilitasi proses remineralisasi gigi dan hemostasis tulang..
-Ini juga digunakan sebagai suplemen gizi, meskipun cara termurah untuk mengganti kalsium adalah melalui penggunaan karbonat dan sitratnya..
-Kalsium fosfat dapat digunakan dalam pengobatan tetani, hipokalsemia laten, dan terapi pemeliharaan. Selain itu, bermanfaat dalam suplementasi kalsium selama kehamilan dan menyusui.
-Ini digunakan dalam pengobatan kontaminasi dengan radio isotop radioaktif (Ra-226) dan strontium (Sr-90). Kalsium fosfat menghalangi penyerapan isotop radioaktif dalam saluran pencernaan, sehingga membatasi kerusakan yang disebabkan oleh mereka.
Lainnya
-Kalsium fosfat digunakan sebagai pakan burung. Selain itu, digunakan dalam pasta gigi untuk mengontrol karang gigi.
-Ini digunakan sebagai agen anti-caking, misalnya untuk mencegah garam meja dari dipadatkan.
-Ia bekerja sebagai zat pemutih untuk tepung. Sementara itu, di dalam lemak babi mencegah warna yang tidak diinginkan dan meningkatkan kondisi menggoreng.
Referensi
- Tung M.S. (1998) Kalsium Fosfat: Struktur, Komposisi, Kelarutan, dan Stabilitas. Dalam: Amjad Z. (eds) Kalsium Fosfat dalam Sistem Biologis dan Industri. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu, dan Honglian Dai. (2018). "Sintesis, Karakterisasi Nano-β-Tricalcium Phosphate dan Penghambatan pada Sel Karsinoma Hepatoseluler," Journal of Nanomaterials, vol. 2018, ID Artikel 7083416, 7 halaman, 2018.
- Combes, Christ dan Rey, Christian. (2010). Kalsium fosfat amorf: sintesis, sifat dan kegunaan dalam biomaterial. Acta Biomaterialia, vol. 6 (n ° 9). hlm. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Tricalcium fosfat. Diperoleh dari: en.wikipedia.org
- Abida et al. (2017). Serbuk Tricalcium fosfat: Kemampuan persiapan, karakterisasi dan pemadatan. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- PubChem. (2019). Kalsium fosfat. Diperoleh dari: pubchem.ncbi.nlm.nih.gov
- Elsevier (2019). Kalsium fosfat. Sains Langsung. Diperoleh dari: sciencedirect.com


