Struktur etane, sifat, kegunaan, dan risiko
itu etana adalah hidrokarbon sederhana dari rumus C2H6 dengan sifat gas tidak berwarna dan tidak berbau yang memiliki penggunaan yang sangat berharga dan beragam dalam sintesis etilena. Selain itu, ini adalah salah satu gas terestrial yang juga telah terdeteksi di planet lain dan bintang di sekitar Tata Surya. Itu ditemukan oleh ilmuwan Michael Faraday pada tahun 1834.
Di antara sejumlah besar senyawa organik yang dibentuk oleh atom karbon dan hidrogen (dikenal sebagai hidrokarbon), ada senyawa organik dalam kondisi suhu dan tekanan lingkungan, yang sangat banyak digunakan di banyak industri..
Ini biasanya berasal dari campuran gas yang disebut "gas alam", produk yang bernilai tinggi bagi umat manusia, dan membentuk metana jenis metana, etana, propana dan butana, antara lain; diklasifikasikan berdasarkan jumlah atom karbon dalam rantai.
Indeks
- 1 Struktur kimia
- 1.1 Sintesis etana
- 2 Properti
- 2.1 Kelarutan etana
- 2.2 Kristalisasi etana
- 2.3 Pembakaran etana
- 2.4 Etana di atmosfer dan di benda angkasa
- 3 Penggunaan
- 3.1 Produksi etilena
- 3.2 Pelatihan bahan kimia dasar
- 3.3 Refrigeran
- 4 Risiko etana
- 5 Referensi
Struktur kimia
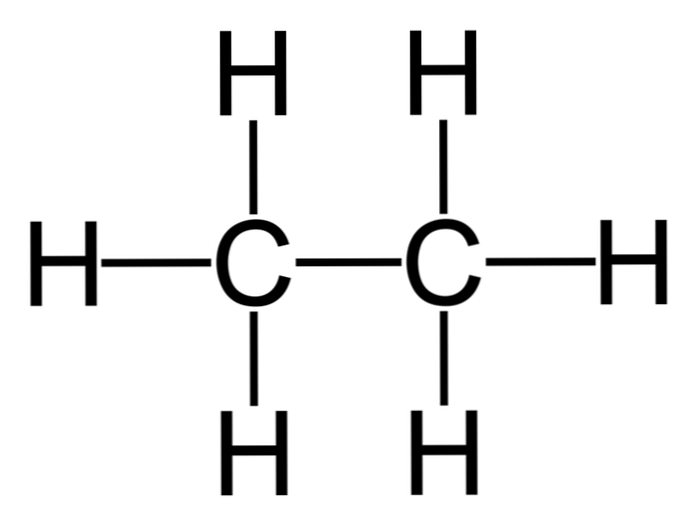
Etana adalah molekul dengan rumus C2H6, biasanya dilihat sebagai penyatuan dua kelompok metil (-CH3) untuk membentuk hidrokarbon dari ikatan karbon-karbon sederhana. Ini juga merupakan senyawa organik paling sederhana setelah metana, direpresentasikan sebagai berikut:
H3C-CH3
Atom karbon dalam molekul ini memiliki hibridisasi sp3, sehingga ikatan molekul menghadirkan rotasi bebas.
Juga, ada fenomena intrinsik etana, yang didasarkan pada rotasi struktur molekul yang sama dan energi minimum yang diperlukan untuk menghasilkan rotasi ikatan 360 derajat, yang oleh para ilmuwan disebut "penghalang etana".
Karena alasan ini, etana dapat terjadi dalam konfigurasi yang berbeda sesuai dengan perputarannya, meskipun terdapat konformasi yang lebih stabil di mana hidrogen berlawanan satu sama lain (seperti yang ditunjukkan pada gambar).

Sintesis etana
Etana dapat dengan mudah disintesis dari elektrolisis Kolbe, suatu reaksi organik di mana dua langkah terjadi: dekarboksilasi elektrokimia (penghilangan gugus karboksil dan pelepasan karbon dioksida) dari dua asam karboksilat, dan kombinasi produk perantara untuk membentuk ikatan kovalen.
Demikian pula, elektrolisis asam asetat mengarah pada pembentukan etana dan karbon dioksida, dan reaksi ini digunakan untuk mensintesis yang pertama..
Oksidasi anhidrida asetat oleh aksi peroksida, sebuah konsep yang mirip dengan elektrolisis Kolbe, juga menghasilkan pembentukan etana.
Dengan cara yang sama, ia dapat dipisahkan secara efisien dari gas alam dan metana melalui proses pencairan, menggunakan sistem kriogenik untuk menangkap gas ini dan memisahkannya dari campuran dengan gas-gas lain..
Proses ekspansi turbo lebih disukai untuk peran ini: campuran gas dilewatkan melalui turbin, menghasilkan ekspansi darinya, hingga suhunya turun di bawah -100ºC.
Sudah pada titik ini, komponen-komponen campuran dapat dibedakan, sehingga etana cair akan dipisahkan dari gas metana dan spesies lain yang terlibat dengan penggunaan distilasi..
Properti
Etana terjadi di alam sebagai gas tidak berbau dan tidak berwarna pada tekanan dan suhu standar (1 atm dan 25 ° C). Ia memiliki titik didih -88,5 ºC, dan titik lebur -182,8 ºC. Selain itu, tidak terpengaruh oleh paparan asam atau basa kuat.
Kelarutan etanol
Molekul etana memiliki konfigurasi simetris dan memiliki gaya tarik lemah yang menyatukannya, yang disebut gaya dispersi.
Ketika etana dicoba larut dalam air, gaya tarik yang terbentuk antara gas dan cairan sangat lemah, sehingga sangat sulit untuk bergabung dengan etana dengan molekul air..
Untuk alasan ini, kelarutan etana sangat rendah, sedikit meningkat ketika tekanan sistem naik.
Kristalisasi etana
Etana dapat dipadatkan, menghasilkan pembentukan kristal etana yang tidak stabil dengan struktur kristal kubik.
Dengan penurunan suhu di luar -183,2 ° C, struktur ini menjadi monoklinik, meningkatkan stabilitas molekulnya.
Pembakaran etana
Hidrokarbon ini, meskipun tidak banyak digunakan sebagai bahan bakar, dapat digunakan dalam proses pembakaran untuk menghasilkan karbon dioksida, air dan panas, yang direpresentasikan sebagai berikut:
2C2H6 + 7O2 → 4CO2 + 6 jam2O + 3120 kJ
Ada juga kemungkinan membakar molekul ini tanpa kelebihan oksigen, yang dikenal sebagai "pembakaran tidak sempurna", dan yang menghasilkan pembentukan karbon amorf dan karbon monoksida dalam reaksi yang tidak diinginkan, tergantung pada jumlah oksigen yang diterapkan :
2C2H6 + 3O2 → 4C + 6H2O + Panas
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Panas
2C2H6 + 5O2 → 4CO + 6H2O + Panas
Di area ini, pembakaran terjadi melalui serangkaian reaksi radikal bebas, yang diberi nomor ratusan reaksi berbeda. Misalnya, senyawa seperti formaldehida, asetaldehida, metana, metanol dan etanol dapat dibentuk dalam reaksi pembakaran yang tidak lengkap..
Ini akan tergantung pada kondisi di mana reaksi terjadi dan reaksi radikal bebas yang terlibat. Etilen juga dapat dibentuk pada suhu tinggi (600-900 ºC), yang merupakan produk yang sangat diinginkan oleh industri.
Etana di atmosfer dan benda angkasa
Ethane hadir di atmosfer planet Bumi dalam jejak, dan diduga bahwa manusia telah berhasil menggandakan konsentrasi ini sejak ia mulai mempraktikkan kegiatan industri.
Para ilmuwan berpikir bahwa sebagian besar keberadaan etana saat ini di atmosfer disebabkan oleh pembakaran bahan bakar fosil, meskipun emisi global etana telah berkurang hampir setengahnya sejak teknologi produksi gas serpih diperbaiki (suatu sumber gas alam).
Spesies ini juga diproduksi secara alami oleh efek sinar matahari pada metana atmosfer, yang menggabungkan kembali dan membentuk molekul etana.
Ethane ada dalam keadaan cair di permukaan Titan, salah satu bulan Saturnus. Ini terjadi dalam jumlah yang lebih besar di Sungai Vid Flumina, yang mengalir lebih dari 400 kilometer ke arah salah satu lautnya. Juga telah dibuktikan senyawa ini pada komet, dan pada permukaan Pluto.
Penggunaan
Produksi etilena
Penggunaan etana terutama didasarkan pada produksi etilena, produk organik yang paling banyak digunakan dalam produksi dunia, melalui proses yang dikenal sebagai steam cracking..
Proses ini terdiri dari melewatkan umpan etana yang diencerkan dengan uap ke oven, memanaskannya dengan cepat tanpa oksigen.
Reaksi terjadi pada suhu yang sangat tinggi (antara 850 dan 900 ºC), tetapi waktu tinggal (waktu yang dihabiskan oleh etana di dalam oven) harus singkat agar reaksi menjadi efektif. Pada suhu yang lebih tinggi, lebih banyak etilen dihasilkan.
Pelatihan bahan kimia dasar
Ethane juga telah dipelajari sebagai komponen utama dalam pembentukan bahan kimia dasar. Klorinasi oksidatif adalah salah satu proses yang diusulkan untuk memperoleh vinil klorida (komponen PVC), menggantikan yang lebih murah dan lebih rumit.
Cairan pendingin
Akhirnya, etana digunakan sebagai zat pendingin dalam sistem kriogenik umum, juga menunjukkan kemampuan untuk membekukan sampel kecil di laboratorium untuk analisis.
Ini adalah pengganti yang sangat baik untuk air, yang membutuhkan waktu lebih lama untuk mendinginkan sampel halus, dan juga dapat menghasilkan pembentukan kristal es yang berbahaya..
Risiko etana
-Ethane memiliki kemampuan untuk menyala, terutama ketika ia terikat dengan udara. Pada persentase 3,0 hingga 12,5% volume etana di udara, suatu campuran eksplosif dapat terbentuk.
-Ini dapat membatasi oksigen di udara di mana ia ditemukan, dan untuk alasan ini ia menghadirkan faktor risiko mati lemas bagi manusia dan hewan yang ada dan terpapar..
-Etana dalam bentuk cairan beku dapat sangat membakar kulit jika bersentuhan langsung dengannya, dan juga bertindak sebagai media kriogenik untuk benda apa pun yang disentuhnya, membekukannya dalam beberapa saat..
-Uap etana cair lebih berat daripada udara dan terkonsentrasi di tanah, ini dapat menimbulkan risiko penyalaan yang dapat menghasilkan reaksi pembakaran rantai.
-Menelan etana dapat menyebabkan mual, muntah, dan pendarahan internal. Menghirup, selain mati lemas, menyebabkan sakit kepala, kebingungan dan perubahan suasana hati. Kematian karena henti jantung mungkin terjadi pada paparan tinggi.
-Ini mewakili gas rumah kaca yang, bersama dengan metana dan karbon dioksida, berkontribusi terhadap pemanasan global dan perubahan iklim yang dihasilkan oleh polusi manusia. Untungnya, ia kurang berlimpah dan tahan lama dibandingkan metana, dan menyerap lebih sedikit radiasi daripada ini.
Referensi
- Britannica, E. (s.f.) Etana. Diperoleh dari britannica.com
- Nes, G. V. (s.f.) Struktur kristal tunggal dan distribusi kerapatan elektron etana, etilen, dan asetilena. Dipulihkan dari rug.nl
- Sites, G. (s.f.). Ethane: Sumber dan Sink. Diperoleh dari sites.google.com
- SoftSchools. (s.f.). Formula Etana. Dipulihkan dari softschools.com
- Wikipedia. (s.f.). Etana. Diperoleh dari en.wikipedia.org


