Energi Aktivasi Kimia Yang Terdiri dari, Perhitungan
itu energi aktivasi kimia (Dari sudut pandang studi kinetik) mengacu pada jumlah energi yang paling mungkin diperlukan untuk memulai reaksi kimia. Menurut teori tabrakan dalam kinetika kimia, dikatakan bahwa semua molekul yang bergerak memiliki sejumlah energi kinetik.
Ini berarti bahwa semakin besar kecepatan gerakan Anda, semakin besar energi kinetik Anda. Dalam pengertian ini, sebuah molekul yang membawa gerakan cepat tidak dapat dibagi menjadi fragmen dengan sendirinya, sehingga harus terjadi tabrakan antara itu dan molekul lain sehingga dapat terjadi reaksi kimia..
Ketika ini terjadi - ketika tabrakan terjadi di antara molekul - sebagian kecil dari energi kinetiknya diubah menjadi energi getaran. Demikian juga, jika pada awal proses, energi kinetiknya tinggi, molekul-molekul yang berpartisipasi dalam tabrakan akan menghadirkan getaran yang sangat besar sehingga beberapa ikatan kimia yang ada akan rusak..
Pemutusan hubungan ini adalah langkah pertama dalam transformasi reaktan menjadi produk; yaitu, dalam pembentukan ini. Di sisi lain, jika pada awal proses ini energi kinetik besarnya kecil, akan ada fenomena "rebound" dari molekul, di mana mereka akan terpisah secara praktis utuh..
Indeks
- 1 Terdiri dari apakah itu??
- 1.1 Kompleks yang diaktifkan
- 2 Bagaimana cara menghitungnya?
- 2.1 Perhitungan energi aktivasi suatu reaksi kimia
- 3 Bagaimana energi aktivasi memengaruhi kecepatan reaksi?
- 4 Contoh perhitungan energi aktivasi
- 5 Referensi
Terdiri dari apa itu??
Mulai dari konsep tumbukan antar molekul untuk memulai reaksi kimia yang dijelaskan sebelumnya, dapat dikatakan bahwa ada jumlah minimum energi yang diperlukan untuk tumbukan terjadi.
Jadi, jika nilai energi kurang dari minimum yang diperlukan ini, tidak akan ada perubahan di antara molekul setelah terjadi tabrakan, yang berarti bahwa ketika energi ini tidak ada, spesies yang terlibat tetap utuh dan tidak akan terjadi perubahan apa pun karena kejutan ini.
Dalam urutan gagasan ini, energi minimum yang diperlukan untuk perubahan terjadi setelah tabrakan antar molekul disebut energi aktivasi.
Dengan kata lain, molekul yang terlibat dalam goncangan harus memiliki jumlah energi kinetik total dengan besarnya sama dengan atau lebih besar dari energi aktivasi sehingga reaksi kimia dapat terjadi..
Juga, dalam banyak kasus, molekul bertabrakan dan berasal dari spesies baru yang disebut kompleks teraktivasi, struktur yang juga disebut "keadaan transisi" karena hanya ada sementara.
Ini disebabkan oleh spesies reaktan akibat tabrakan dan sebelum pembentukan produk-produk reaksi.
Kompleks yang diaktifkan
Kompleks teraktivasi yang disebutkan di atas membentuk spesies yang stabilitasnya sangat rendah tetapi, pada gilirannya, memiliki sejumlah besar energi potensial.
Diagram berikut menunjukkan transformasi reaktan menjadi produk, dinyatakan dalam bentuk energi dan mencatat bahwa besarnya energi kompleks yang diaktifkan yang terbentuk jauh lebih besar daripada reaktan dan produk..
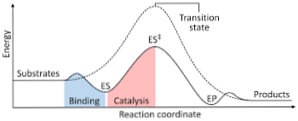
Jika pada akhir reaksi produk memiliki stabilitas yang lebih besar daripada zat reaktan, pelepasan energi terjadi dalam bentuk panas, memberikan reaksi eksotermik..
Sebaliknya, jika reaktan menghasilkan stabilitas yang lebih besar daripada produk, itu berarti bahwa campuran reaksi memanifestasikan penyerapan energi dalam bentuk panas dari lingkungannya, menghasilkan reaksi endotermik..
Demikian juga, jika satu kasus atau yang lain terjadi, diagram harus dibangun, seperti yang ditunjukkan sebelumnya, di mana energi potensial dari sistem yang bereaksi terhadap kemajuan atau kemajuan reaksi diplot..
Dengan cara ini, perubahan energi potensial yang terjadi ketika reaksi berlangsung diperoleh dan reaktan diubah menjadi produk.
Bagaimana cara menghitungnya?
Energi aktivasi dari suatu reaksi kimia berhubungan erat dengan konstanta kecepatan reaksi itu, dan ketergantungan konstanta ini pada suhu direpresentasikan oleh persamaan Arrhenius:
k = Ae-Ea / RT
Dalam ungkapan ini k mewakili konstanta laju reaksi (yang tergantung pada suhu) dan parameter A itu disebut faktor frekuensi, dan itu adalah ukuran frekuensi tabrakan antar molekul.
Untuk bagiannya, e mengekspresikan dasar dari rangkaian logaritma natural. Itu dinaikkan ke kekuatan yang sama dengan hasil bagi negatif dari energi aktivasi (Ea) antara produk yang dihasilkan dari konstanta gas (R) dan suhu absolut (T) sistem untuk dipertimbangkan.
Perlu dicatat bahwa faktor frekuensi dapat dianggap sebagai konstanta dalam sistem reaksi tertentu pada rentang suhu yang luas.
Ungkapan matematis ini semula diduga oleh ahli kimia asal Belanda Jacobus Henricus van't Hoff pada tahun 1884, tetapi yang memberinya validitas ilmiah dan menafsirkan premisnya adalah ahli kimia kelahiran Swedia, Svante Arrhenius, pada tahun 1889..
Perhitungan energi aktivasi dari suatu reaksi kimia
Persamaan Arrhenius menunjukkan proporsionalitas langsung yang ada antara konstanta kecepatan reaksi dan frekuensi bentrokan antara molekul.
Juga, persamaan ini dapat direpresentasikan dengan cara yang lebih nyaman dengan menerapkan sifat logaritma natural pada setiap sisi persamaan, dengan memperoleh:
ln k = ln A - Ea / RT
Saat menata ulang istilah untuk mendapatkan persamaan garis (y = mx + b), ungkapan berikut ini tercapai:
ln k = (- Ea / R) (1 / T) + ln A
Jadi, ketika membuat grafik ln k versus 1 / T kita memperoleh garis lurus, di mana ln k mewakili koordinat y, (- A / R) mewakili kemiringan garis (m), (1 / T) mewakili koordinat x, dan ln A mewakili persimpangan dengan sumbu ordinat (b).
Seperti dapat dilihat, kemiringan yang dihasilkan dari perhitungan ini sama dengan nilai -Ea / R. Ini menyiratkan bahwa, jika diinginkan untuk mendapatkan nilai energi aktivasi dengan ungkapan ini, pembersihan sederhana harus dilakukan, menghasilkan:
Ea = -mR
Di sini kita tahu nilai m dan R adalah konstan sama dengan 8,314 J / K · mol.
Bagaimana energi aktivasi memengaruhi kecepatan reaksi?
Ketika mencoba membuat gambar energi aktivasi, itu dapat dianggap sebagai penghalang yang tidak memungkinkan terjadi reaksi antara molekul energi yang lebih rendah..
Seperti dalam reaksi umum yang terjadi bahwa jumlah molekul yang dapat bereaksi cukup besar, kecepatan - dan yang setara, energi kinetik dari molekul-molekul ini - bisa sangat bervariasi.
Biasanya terjadi bahwa hanya sejumlah kecil totalitas molekul yang mengalami tabrakan - molekul yang memiliki kecepatan gerakan lebih besar - menghadirkan energi kinetik yang cukup untuk dapat mengatasi besarnya energi aktivasi. Jadi, molekul-molekul ini tepat dan mampu menjadi bagian dari reaksi.
Menurut persamaan Arrhenius, tanda negatif - yang mendahului hasil bagi antara energi aktivasi dan produk dari konstanta gas oleh suhu absolut - menyiratkan bahwa konstanta kecepatan menurun karena ada peningkatan energi aktivasi, serta pertumbuhan ketika suhu meningkat.
Contoh perhitungan energi aktivasi
Untuk menghitung energi aktivasi dengan membuat grafik, menurut persamaan Arrhenius, kita mendapatkan bahwa konstanta laju reaksi dekomposisi asetaldehida telah diukur pada lima suhu yang berbeda dan kami ingin menentukan energi aktivasi untuk reaksi, yang dinyatakan sebagai:
CH3CHO (g) → CH4(g) + CO (g)
Data dari lima pengukuran adalah sebagai berikut:
k (1 / M1/2· S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Pertama, untuk menyelesaikan hal yang tidak diketahui ini dan menentukan energi aktivasi, kita harus membuat grafik ln k vs 1 / T (y vs x), untuk mendapatkan garis lurus dan dari sini ambil kemiringan dan temukan nilai Ea, seperti yang dijelaskan.
Mengubah data pengukuran, sesuai dengan persamaan Arrhenius [ln k = (- Ea / R) (1 / T) + ln A] nilai-nilai berikut ditemukan untuk y dan x, masing-masing:
Pada k: (-4.51) - (-3.35) - (-2.254) - (-1.070) - (-0.237)
1 / T (K-1): 1.43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Dari nilai-nilai ini dan melalui perhitungan matematis dari kemiringan - baik di komputer atau dalam kalkulator, dengan menggunakan ekspresi m = (Y2-Y1) / (X2-X1) atau menggunakan metode regresi linier - kita memperoleh bahwa m = -Ea / R = -2.09 * 104 K. Jadi:
Ea = (8.314 J / K · mol) (2.09 * 104 K)
= 1.74 * 105 = 1.74 * 102 kJ / mol
Untuk menentukan energi aktivasi lainnya melalui cara grafis, prosedur serupa dilakukan.
Referensi
- Wikipedia. (s.f.). Energi Aktivasi. Diperoleh dari en.wikipedia.org
- Chang, R. (2007). Kimia, edisi kesembilan. Meksiko: McGraw-Hill.
- Britannica, E. (s.f.) Energi aktivasi. Diperoleh dari britannica.com
- Moore, J. W. dan Pearson, R. G. (1961). Kinetika dan Mekanisme. Diperoleh dari books.google.co.ve
- Kaesche, H. (2003). Korosi Logam: Prinsip Fisikaokimia dan Masalah Saat Ini. Diperoleh dari books.google.co.ve


