Penyeimbangan Metode dan Contoh Persamaan Kimia
itu menyeimbangkan persamaan kimia menyiratkan bahwa semua elemen yang ada dalam persamaan tersebut memiliki jumlah atom yang sama di setiap sisi. Untuk mencapai ini, perlu menggunakan metode penyeimbangan untuk menetapkan koefisien stoikiometrik yang cocok untuk setiap spesies yang ada dalam reaksi..
Persamaan kimia adalah representasi, melalui simbol, dari apa yang terjadi selama reaksi kimia antara dua atau lebih zat. Reaktan berinteraksi satu sama lain dan, tergantung pada kondisi reaksi, satu atau lebih senyawa yang berbeda akan diperoleh sebagai produk..
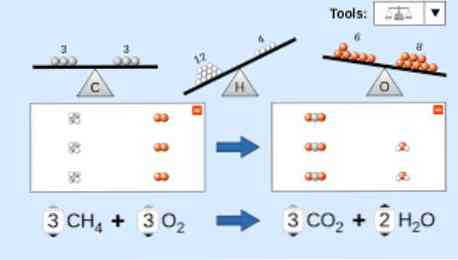
Ketika menggambarkan persamaan kimia, berikut ini harus diperhitungkan: Pertama, zat reaktan ditulis di sisi kiri persamaan, diikuti oleh panah searah atau dua panah horizontal yang berlawanan, tergantung pada jenis reaksi yang dilakukan. jubah.
Indeks
- 1 Metode menyeimbangkan persamaan kimia
- 1.1 Neraca persamaan kimia dengan coba-coba (juga disebut dengan inspeksi atau uji coba)
- 1.2 Penyeimbangan aljabar persamaan kimia
- 1.3 Pengguliran persamaan redoks (metode ion-elektron)
- 2 Contoh persamaan kimia penyeimbang
- 2.1 Contoh pertama
- 2.2 Contoh kedua
- 2.3 Contoh ketiga
- 3 Referensi
Metode penyeimbangan persamaan kimia
Mengambil sebagai dasar bahwa reaktan dan produk diketahui, dan bahwa formula mereka diekspresikan dengan benar pada sisi yang sesuai dengan mereka, kami melanjutkan untuk menyeimbangkan persamaan sesuai dengan metode berikut.
Menyeimbangkan persamaan kimia dengan coba-coba (juga disebut dengan inspeksi atau uji coba)
Ini didasarkan pada stoikiometri reaksi dan mencoba untuk mencoba dengan koefisien yang berbeda untuk menyeimbangkan persamaan, selama bilangan bulat terkecil yang mungkin dipilih dengan jumlah atom yang sama dari setiap elemen diperoleh pada kedua sisi. dari reaksi.
Koefisien reaktan atau produk adalah angka yang mendahului rumusnya, dan itu adalah satu-satunya angka yang dapat diubah ketika menyeimbangkan persamaan, karena mengubah subskrip rumus akan mengubah identitas senyawa dalam pertanyaan.
Hitung dan bandingkan
Setelah mengidentifikasi setiap elemen dari reaksi dan menempatkannya di sisi yang benar, kami melanjutkan untuk menghitung dan membandingkan jumlah atom dari setiap elemen yang ada dalam persamaan dan menentukan yang harus seimbang.
Kemudian, kami melanjutkan dengan menyeimbangkan setiap elemen (satu per satu), dengan menempatkan seluruh koefisien sebelum setiap formula yang berisi elemen tidak seimbang. Biasanya unsur-unsur logam diseimbangkan terlebih dahulu, kemudian unsur-unsur non-logam dan akhirnya atom oksigen dan hidrogen.
Dengan cara ini, setiap koefisien melipatgandakan semua atom dari rumus sebelumnya; jadi ketika menyeimbangkan elemen yang lain dapat tidak seimbang, tetapi ini diperbaiki karena reaksi seimbang.
Akhirnya, dikuatkan oleh hitungan terakhir bahwa seluruh persamaan itu seimbang dengan benar, yaitu, bahwa ia mematuhi hukum kekekalan materi.
Penyeimbangan aljabar persamaan kimia
Untuk menggunakan metode ini, prosedur ditetapkan untuk memperlakukan koefisien persamaan kimia sebagai tidak diketahui sistem yang harus dipecahkan..
Pertama, elemen spesifik dari reaksi diambil sebagai referensi dan koefisien ditempatkan sebagai huruf (a, b, c, d ...), yang mewakili yang tidak diketahui, sesuai dengan atom yang ada dari elemen tersebut di setiap molekul (jika suatu spesies tidak mengandung elemen yang ditempatkan "0").
Setelah mendapatkan persamaan pertama ini, persamaan untuk unsur-unsur lain yang ada dalam reaksi ditentukan; akan ada banyak persamaan karena ada unsur-unsur dalam reaksi tersebut.
Akhirnya, yang tidak diketahui ditentukan oleh salah satu metode aljabar reduksi, ekualisasi atau substitusi dan koefisien diperoleh yang menghasilkan persamaan yang seimbang dengan benar.
Menyeimbangkan persamaan redoks (metode ion-elektron)
Pertama, reaksi umum (tidak seimbang) ditempatkan dalam bentuk ioniknya. Kemudian persamaan ini dibagi menjadi dua reaksi setengah, oksidasi dan reduksi, masing-masing menyeimbangkan sesuai dengan jumlah atom, jenisnya dan muatannya..
Misalnya, untuk reaksi yang terjadi dalam medium asam, molekul H ditambahkan.2Atau untuk menyeimbangkan atom oksigen dan tambahkan H+ untuk menyeimbangkan atom hidrogen.
Sebaliknya, dalam media alkali ditambahkan ion OH dalam jumlah yang sama- pada dua sisi persamaan untuk setiap ion H+, dan di mana ion H muncul+ dan OH- mereka datang bersama untuk membentuk molekul H2O.
Tambahkan elektron
Kemudian Anda harus menambahkan elektron sebanyak yang diperlukan untuk menyeimbangkan muatan, setelah menyeimbangkan materi di setiap setengah reaksi.
Setelah bergulir dari setiap reaksi setengah, ini ditambahkan dan memuncak dengan menyeimbangkan persamaan akhir dengan coba-coba. Jika ada perbedaan dalam jumlah elektron dari dua setengah reaksi, satu atau keduanya harus dikalikan dengan koefisien yang sama dengan jumlah ini.
Akhirnya, harus dikuatkan bahwa persamaan mencakup jumlah atom yang sama dan jenis atom yang sama, selain memiliki muatan yang sama di kedua sisi persamaan global.
Contoh persamaan kimia penyeimbang
Contoh pertama
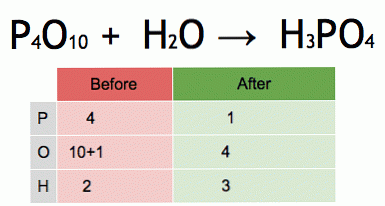
Ini adalah animasi persamaan kimia seimbang. Fosfor pentoksida dan air dikonversi menjadi asam fosfat.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
Contoh kedua
Anda memiliki reaksi pembakaran etana (tidak seimbang).
C2H6 + O2 → CO2 + H2O
Menggunakan metode coba-coba untuk menyeimbangkannya, diamati bahwa tidak ada unsur yang memiliki jumlah atom yang sama di kedua sisi persamaan. Jadi, itu dimulai dengan keseimbangan karbon, menambahkan dua sebagai koefisien stoikiometrik yang menyertainya di sisi produk.
C2H6 + O2 → 2CO2 + H2O
Karbon telah seimbang di kedua sisi, jadi kami melanjutkan untuk menyeimbangkan hidrogen dengan menambahkan tiga molekul air.
C2H6 + O2 → 2CO2 + 3j2O
Akhirnya, karena ada tujuh atom oksigen di sisi kanan persamaan dan itu adalah elemen terakhir yang masih seimbang, bilangan pecahan 7/2 ditempatkan di depan molekul oksigen (walaupun seluruh koefisien umumnya lebih disukai).
C2H6 + 7 / 2O2 → 2CO2 + 3j2O
Kemudian verifikasi bahwa di setiap sisi persamaan ada jumlah atom karbon (2), hidrogen (6) dan oksigen (7) yang sama.
Contoh ketiga
Oksidasi besi oleh ion dikromat terjadi dalam media asam (tidak seimbang dan dalam bentuk ionik).
Iman2+ + Cr2O72- → Iman3+ + Cr3+
Menggunakan metode ion-elektron untuk penyeimbangannya, ia dibagi menjadi dua reaksi setengah.
Oksidasi: Iman2+ → Iman3+
Pengurangan: Cr2O72- → Cr3+
Karena atom besi sudah seimbang (1: 1), sebuah elektron ditambahkan di sisi produk untuk menyeimbangkan muatan.
Iman2+ → Iman3+ + e-
Sekarang atom-atom Cr seimbang, menambahkan dua ke sisi kanan persamaan. Kemudian, ketika reaksi berlangsung dalam medium asam, tujuh molekul H ditambahkan.2Atau di sisi produk untuk menyeimbangkan atom oksigen.
Cr2O72- → 2Cr3+ + 7 jam2O
Untuk menyeimbangkan atom H, empat belas ion H ditambahkan+ di sisi reaktan dan, setelah menyamakan material, muatan diseimbangkan dengan penambahan enam elektron di sisi yang sama.
Cr2O72- +14 jam+ + 6e- → 2Cr3+ + 7 jam2O
Akhirnya, kedua setengah reaksi ditambahkan, tetapi karena hanya ada satu elektron dalam reaksi oksidasi, semua ini harus dikalikan dengan enam.
6Fe2+ + Cr2O72- +14 jam+ + 6e- → Iman3+ + 2Cr3+ + 7 jam2O + 6e-
Akhirnya, elektron harus dihilangkan di kedua sisi persamaan ion global, memverifikasi bahwa muatan dan materi mereka seimbang dengan benar.
Referensi
- Chang, R. (2007). Kimia (Edisi ke-9). McGraw-Hill.
- Hein, M., dan Arena, S. (2010). Yayasan Kimia Perguruan Tinggi, Alternatif. Diperoleh dari books.google.co.ve
- Tuli, G. D., dan Soni, P. L. (2016). Bahasa Kimia atau Persamaan Kimia. Diperoleh dari books.google.co.ve
- Penerbitan Cepat (2015). Persamaan dan Jawaban Kimia (Panduan Studi Speedy). Diperoleh dari books.google.co.ve


